Показания к применению
«Пеленочный» дерматит, опрелость, потница, поверхностные раны, ожоги, дерматит, язвенные поражения кожи, пролежни; экзема в стадии обострения, простой герпес, стрептодермия, трофические язвы.
Возможные аналоги (заменители)
Цинковая мазь (от 13.00 руб), Цинковая паста (от 39.31 руб), Диадерм (от 58.00 руб), Деситин (от 245.00 руб)
Действующее вещество, группа
Состав и формы выпуска
Порошок полностью состоит из окиси цинка без лишних добавлений.
Белый порошок в стеклянных флаконах по 80 грамм, однородный и рассыпчатый.
Лекарственная форма
Линимент, мазь для наружного применения, паста для наружного применения
Лечебные свойства
Медикамент обладает антисептическими, подсушивающими, адсорбирующими, вяжущими и дезинфицирующими свойствами. Вещество на основе цинковых соединений проявляет свою терапевтическую активность благодаря свойству сворачивать белковые структуры и синтезировать новые альбумины. Если наносить порошок на поврежденные слизистые и кожные структуры, то возникает снижение экссудативных процессов, а местные реакции раздражения и воспаления также исчезают.
После наружного использования средство проявляет себя как адсорбент и создает защитную пленку на кожном покрове, слизистой оболочке. Благодаря такому эффекту эпидермис становится защищенным от агрессивной внешней среды. Порошок универсален в использовании, с помощью него можно делать мазь или пасту. Окись цинка считается одним из лучших белил для осветления кожи.
Условия продажи
Купить окись цинка можно в свободной продаже.
Условия хранения
Порошок препарата не требует каких-либо особых условий хранения.
Фармакодинамика и фармакокинетика
Порошок окиси цинка является местным лечебным средством, эффективность которого проявляется благодаря его способности создавать альбуминаты и денатурировать белки.
При нанесении порошка на пораженные слизистые или кожные поверхности наблюдается снижение выраженности протекающих экссудативных процессов и уменьшение местных проявлений раздражения и воспаления. Данное лекарственное средство обладает адсорбирующими эффектами и способствует образованию защитного покрытия на кожных и слизистых покровах, тем самым предохраняя их от воздействия внешних раздражающих факторов.
Также порошок препарата используется в фармакологической практике для изготовления различных наружных лекарственных форм: линименты, присыпки, пасты и мази окиси цинка.
Срок годности
В закрытом заводском флаконе порошок может храниться на протяжении 2-х лет.
Противопоказания
Гиперчувствительность к компонентам Цинка окиси.
Цинка окись, инструкция по применению
Перед применением препарата необходимо провести гигиену (вымыть и высушить) предполагаемой области использования порошка.
Нанесение самого порошка, как и прочих средств приготовленных на его основе (линименты, присыпки, пасты, мази), осуществляется исключительно наружно.
Препараты цинка окиси показано наносить тонким слоем на различные проблемные кожные и слизистые поверхности, с частотой использования 4-6 раз в сутки. Продолжительность такого лечения индивидуальна и зависит от этиологии и выраженности наблюдаемых повреждений.
Допускают использование препаратов под повязку (при лечении различных ран и ожогов).
Для профилактики детских опрелостей и пеленочного дерматита рекомендуют обрабатывать препаратами участки тела ребенка, длительно контактирующие с мокрым бельем.
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии:
+30Zn 1s22s22p63s23p63d104s2
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Температура плавления цинка 420°С, температура кипения 906°С, плотность 7,13 г/см3.
Оксид цинка – неорганическое вещество, имеет химическую формулу ZnO.
Краткая характеристика оксида цинка:
Оксид цинка – неорганическое вещество белого цвета.
Так как валентность цинка равна двум, то оксид цинка содержит один атом кислорода и один атом цинка.
Химическая формула оксида цинка ZnO.
При нагревании желтеет. При температуре 1800 оС сублимируется.
В воде не растворяется.
Оксид цинка относится к малотоксичным веществам. Его пыль вредна для органов дыхания.
Физические свойства оксида цинка:
| Наименование параметра: | Значение: |
| Химическая формула | ZnO |
| Синонимы и названия иностранном языке | zinc oxide (англ.)
цинкит (рус.) цинковые белила (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые гексагональные кристаллы |
| Цвет | белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 5610 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 5,61 |
| Температура сублимации, °C | 1800 |
| Температура плавления, °C | 1975 |
| Молярная масса, г/моль | 81,408 |
| Теплопроводность, Вт/(м·К) | 54 |
Получение оксида цинка:
В природе встречается в виде минерала цинкита, который практически полностью состоит из оксида цинка.
Оксид цинка также получают в результате следующих химических реакций:
- 1. сжиганием цинка в кислороде:
2Zn + О2 -> 2ZnО (t > 250 oC).
- 2. путем термического разложения гидроксида цинка:
Zn(OH)2 -> ZnO + H2О (t = 100-250 oC).
- 3. путем термического разложения карбоната цинка:
ZnCO3 -> ZnO + CO2 (t = 200-300 oC).
- 4. путем термического разложения нитрата цинка:
2Zn(NO3)2 -> 2ZnO + 4NO2 + O2 (t = 300-500 oC).
- 5. путем окислительного обжига сульфида цинка:
2ZnS + 3O2 -> 2ZnO + 2SO2 (t = 800-1000 oC).
- 6. путем термического разложения ацетата цинка.
Химические свойства оксида цинка. Химические реакции оксида цинка:
Оксид цинка относится к амфотерным оксидам. Он проявляет в зависимости от условий либо основные, либо кислотные свойства.
Химические свойства оксида цинка аналогичны свойствам амфотерных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида цинка с углеродом:
ZnO + C -> Zn + CO (t = 1200-1300 oC).
В результате реакции образуется цинк и оксид углерода (II). Таким образом, цинк восстанавливается из оксида цинка коксом или углем при температуре 1200-1300 oC.
2. реакция оксида цинка с оксидом кремния:
ZnО + SiО2 -> ZnSiО3 (t = 1200-1400 oC),
2ZnО + SiО2 -> Zn2SiО4 (t = 900-1000 oC).
Оксид кремния является кислотным оксидом. В результате реакции в первом случае образуется соль – метасиликат цинка, во втором – ортосиликат цинка.
3. реакция оксида цинка с оксидом серы:
ZnО + SО2 -> ZnSО3.
Оксид серы является кислотным оксидом. В результате реакции образуется соль – сульфит цинка.
4. реакция оксида цинка с оксидом бора:
ZnО + B2О3 -> Zn(BО2)2.
В результате реакции образуется соль – борат цинка.
5. реакция оксида цинка с оксидом углерода:
ZnО + СО -> Zn + CO2 (t = 700 oC).
В результате реакции образуется цинк и углекислый газ.
6. реакция оксида цинка с оксидом бария:
ZnО + BaО -> BaZnО2 (t = 1100 oC).
В результате реакции образуется соль – цинкат бария.
7. реакция оксида цинка с оксидом хрома:
ZnО + CrО3 -> ZnCrО4.
В результате реакции образуется соль – хромат цинка.
8. реакция оксида цинка с оксидом железа:
ZnО + Fe2О3 -> Fe2ZnО4 (t = 800-1000 oC),
ZnО + Fe2О3 -> ZnFe2О4 (t = 800-1000 oC).
В результате реакции образуется оксид железа-цинка.
9. реакция оксида цинка с оксидом молибдена:
ZnО + MoО3 -> ZnMoО4.
В результате реакции образуется соль – молибдат цинка.
10. реакция оксида цинка с оксидом ванадия:
2ZnО + VО2 -> Zn2VО4 (t = 1500-1700 oC).
В результате реакции образуется соль – тетраоксованадат цинка.
11. реакция оксида цинка с оксидом марганца:
3ZnО + MnО2 -> MnZn3О5 (t = 700-800 oC),
ZnО + Mn2О3 -> ZnMn2О4 (t = 900 oC).
В результате реакции образуется в первом случае – оксид марганца-трицинка, во втором – оксид марганца-цинка.
12. реакция оксида цинка с оксидом вольфрама:
ZnО + WО3 -> ZnWО4 (t = 600-800 oC).
В результате реакции образуется соль – вольфрамат цинка.
13. реакция оксида цинка с сульфидом цинка:
2ZnO + ZnS -> 3Zn + SO2.
В результате химической реакции получается цинк и оксид цинка.
14. реакция оксида цинка с хлоридом цинка и водой:
ZnO + ZnCl2 + H2O -> 2Zn(OH)Cl (t = 100-130 oC).
В результате химической реакции получается быстро (2-3 минуты) твердеющая масса – хлорид-гидроксид цинка (т.н. цинковый цемент). Хлорид цинка – концентрированный раствор.
15. реакция оксида цинка с плавиковой кислотой:
ZnO + 2HF -> ZnF2 + H2O.
В результате химической реакции получается соль – фторид цинка и вода.
16. реакция оксида цинка с азотной кислотой:
ZnO + 2HNO3 -> 2Zn(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат цинка и вода.
17. реакция оксида цинка с ортофосфорной кислотой:
3ZnO + 2H3PO4 -> Zn3(PO4)2 + 3H2O.
В результате химической реакции получается соль – ортофосфат цинка и вода. Ортофосфорная кислота изначально растворена в воде.
Аналогично проходят реакции оксида цинка и с другими кислотами.
18. реакция оксида цинка с бромистым водородом (бромоводородом):
ZnO + 2HBr -> ZnBr2 + H2O.
В результате химической реакции получается соль – бромид цинка и вода.
19. реакция оксида цинка с йодоводородом:
ZnO + 2HI -> ZnI2 + H2O.
В результате химической реакции получается соль – йодид цинка и вода.
20. реакция оксида цинка с сероводородом:
ZnO + H2S -> ZnS + H2O (t = 450-550 oC).
В результате химической реакции получается соль – сульфид цинка и вода.
21. реакция оксида цинка с гидроксидом натрия:
ZnO + 2NaOH -> Na2ZnO2 + H2O (t = 500-600 oC).
В результате химической реакции получается соль – цинкат натрия и вода.
22. реакция оксида цинка с гидроксидом натрия и водой:
ZnO + NaOH + H2O -> Na[Zn(OН)3] (t = 100 oC),
ZnO + 2NaOH + H2O -> Na2[Zn(OН)4] (t = 90 oC).
В результате химической реакции в первом случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 40 %. Реакция протекает при кипении.
В результате химической реакции во втором случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 60 %. Реакция протекает при температуре 90 oC.
23. реакция оксида цинка с гидратом аммиака:
ZnО + 4(NH3•H2O) -> [Zn(NH3)4](OH)2 + 3H2O.
В результате реакции образуются гидроксид тетраамминцинка и вода. Гидрат аммиака – концентрированный раствор.
24. реакция оксида цинка с хлоридом аммония:
ZnО + 2NH4Cl -> ZnCl2 + 2NH3 + H2O (t°).
В результате реакции образуются хлорид цинка, аммиак и вода.
Применение и использование оксида цинка:
Оксид цинка применяется в качестве наполнителя, компонента или катализатора в химической, фармацевтической, резинотехнической, лакокрасочной и нефтеперерабатывающей промышленности, в производстве стекла и керамики, а также медицине.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 -> 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
При пирометаллургическом способе, который использовался издавна, оксид цинка восстанавливают углём или коксом при 1200—1300 °C:
ZnO + С -> Zn + CO
Далее цинк очищают от примесей.
В настоящее время основной способ получения цинка — электролитический (гидрометаллургический). При этом сульфид цинка обрабатывают серной кислотой:
ZnO + H2SO4 -> ZnSO4 + H2O
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
Качественная реакция на ионы цинка — взаимодействие избытка солей цинка с щелочами. При этом образуется белый осадок гидроксида цинка.

Например, хлорид цинка взаимодействует с гидроксидом натрия:
ZnCl2 + 2NaOH -> Zn(OH)2 + 2NaCl

При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]

Обратите внимание, если мы поместим соль цинка в избыток раствора щелочи, то белый осадок гидроксида цинка не образуется, т.к. в избытке щелочи соединения цинка сразу переходят в комплекс:
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl

Химические свойства
1. Цинк – сильный восстановитель. Цинк – довольно активный металл, но на воздухе он устойчив, так как покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления. При нагревании цинк реагирует со многими неметаллами.
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Zn + I2 -> ZnI2
Реакция цинка с иодом при добавлении воды:

1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S -> ZnS

1.3. Цинк реагируют с фосфором. При этом образуется бинарное соединение — фосфид:
3Zn + 2P -> Zn3P2
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 -> 2ZnO

2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn0 + H2+O -> Zn+2O + H20
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например, цинк реагирует с соляной кислотой:
Zn + 2HCl -> ZnCl2 + H2?
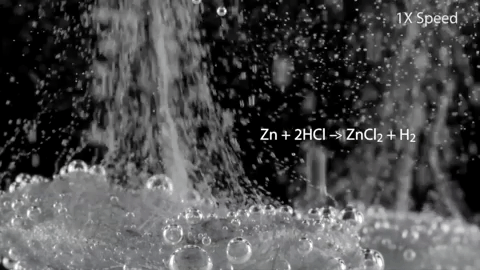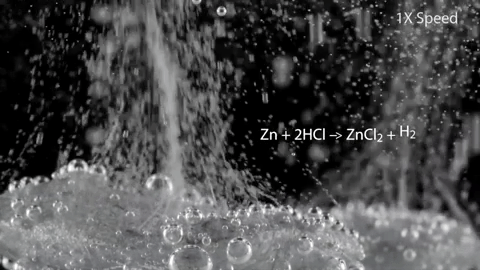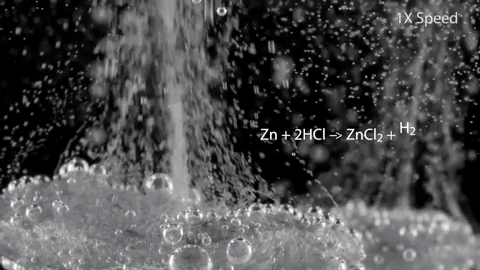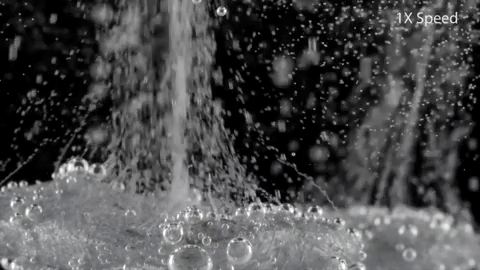
Демонстрация количества выделения водорода при реакции цинка с кислотой:

Цинк реагирует с разбавленной серной кислотой:
Zn + H2SO4 -> ZnSO4 + H2
2.3. Цинк реагирует с концентрированной серной кислотой. В зависимости от условий возможно образование различных продуктов. При нагревании гранулированного цинка с концентрированной серной кислотой образуются оксид серы (IV), сульфат цинка и вода:
Zn + 2H2SO4(конц.) -> ZnSO4 + SO2 + 2H2O
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
4Zn + 5H2SO4(конц.) -> 4ZnSO4 + H2S + 4H2O
2.4. Аналогично: при нагревании гранулированного цинка с концентрированной азотной кислотой образуются оксид азота (IV), нитрат цинка и вода:
Zn + 4HNO3(конц.)-> Zn(NO4)2 + 2NO2 + 2H2O
При нагревании цинка с очень разбавленной азотной кислотой образуются нитрат аммония, нитрат цинка и вода:
4Zn + 10HNO3(оч. разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2

Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
Zn + 2NаОН(крист.) Nа2ZnО2 + Н2
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
Zn + 4NH3 + 2H2O -> [Zn(NH3)4](OH)2 + H2
2.6. Цинк вытесняет менее активные металлы из оксидов и солей.
Например, цинк вытесняет медь из оксида меди (II):
Zn + CuO -> Cu + ZnO
Еще пример: цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Pb(NO3)2 + Zn = Zn(NO3)2 + Pb
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
4Zn + KNO3 + 7KOH = NН3 + 4K2ZnO2 + 2H2O
4Zn + 7NaOH + 6H2O + NaNO3 = 4Na2[Zn(OH)4] + NH3
3Zn + Na2SO3 + 8HCl = 3ZnCl2 + H2S + 2NaCl + 3H2O
Zn + NaNO3 + 2HCl = ZnCl2 + NaNO2 + H2O
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
2Zn(NO3)2 -> 2ZnO + 4NO2 + O2
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
2ZnSO4-> 2ZnO + 2SO2 + O2
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например, тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами.
Например, гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2NaHCO3
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
K2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2KHCO3
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например, с соляной кислотой:
Na2[Zn(OH)4] + 4HCl(избыток) -> 2NaCl + ZnCl2 + 4H2O
Правда, под действием небольшого количества (недостатка) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Na2[Zn(OH)4] + 2НCl(недостаток) -> Zn(OH)2? + 2NaCl + 2H2O
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Na2[Zn(OH)4] + 2HNO3(недостаток) -> Zn(OH)2? + 2NaNO3 + 2H2O
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Na2[Zn(OH)4] -> Na2ZnO2 + 2H2O?
K2[Zn(OH)4] -> K2ZnO2 + 2H2O?
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn2+ + H2O = ZnOH+ + H+
II ступень: ZnOH+ + H2O = Zn(OH)2 + H+
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
ZnO + Na2O -> Na2ZnO2
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка:
K2ZnO2 + 4HCl (избыток) -> 2KCl + ZnCl2 + 2H2O
СaZnO2 + 4HCl (избыток) = CaCl2 + ZnCl2 + 2H2O
Na2ZnO2 + 4HNO3 -> Zn(NO3)2 + 2NaNO3 + 2H2O
Na2ZnO2 + 2H2SO4 -> ZnSO4 + Na2SO4 + 2H2O
Под действием избытка воды цинкаты переходят в комплексные соли:
K2ZnO2 + 2H2O = K2[Zn(OH)4]
Na2ZnO2 + 2H2O = Na2[Zn(OH)4]
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl -> ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
ZnS + 8HNO3(конц.) -> ZnSO4 + 8NO2 + 4H2O
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
ZnS + 4H2SO4(конц.) = ZnSO4 + 4SO2 + 4H2O
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Способ применения
Порошок в небольшом количестве или мазь из него наносится равномерным и тонким слоем на поврежденное место по 4-6 раз в сутки. Можно надевать окклюзивную повязку с целью усиления эффекта на места сгиба суставов. Можно также использовать для профилактики опрелостей.
При беременности и грудном вскармливании
Противопоказаний нет, можно использовать по стандартной схеме лечения.
Противопоказания и меры предосторожности
Усиленная чувствительность к веществу.
Салицилово-цинковая мазь

Ярославская фармфабрика, Россия
Средство состоит из комбинации окиси цинка и салициловой кислоты. Такая комбинация помогает подсушить лучше кожу и бороться эффективнее с воспаленными угрями.
Плюсы:
- Доступная цена
- Эффективность.
Минусы:
- Может раздражать кожу
- Нельзя много наносить.
Цинковая мазь
Тверская фармацевтическая фабрика, Россия
С помощью цинковой мази можно заживлять различные раны, а также бороться с воспаленными угрями. Средство характеризуется высокой безопасностью.
Плюсы:
- Эффективность и доступность
- Дешево стоит.
Минусы:
- Не всегда помогает
- Пачкает одежду.
Как применять: дозировка и курс лечения
Наружно, в виде мази, пасты, линимента Цинка окиси. Вымыть и высушить пораженную область. Мазь наносят тонким слоем на пораженные участки кожи 4-6 раз в день. Курс лечения Цинка окисью — до 1 мес. Количество наносимой мази зависит от обширности очага поражения. При лечении ожогов и ран — накладывают повязку с мазью. Профилактически у детей обрабатывают Цинка окисью участки тела, находящиеся в длительном контакте с мокрым бельем.
Противовоспалительное местное средство, оказывает подсушивающее, адсорбирующее, вяжущее и антисептическое действие. Образует альбуминаты и денатурирует белки. При нанесении на пораженную поверхность уменьшает явления экссудации, воспаления и раздражения тканей, образует защитный барьер от действия раздражающих факторов.
Побочные действия
Редко: возможны аллергические реакции на компоненты Цинка окиси.
Особые указания
Мазь предназначена только для наружного применения. Не допускать попадания Цинка окиси в глаза.
При беременности и лактации
Нет противопоказаний к наружному применению препарата беременными и кормящими женщинами.
Взаимодействие
Значимого лекарственного взаимодействия при лечении Цинка окисью совместно с другими препаратами не выявлено.
Аналоги (дженерики, синонимы)
- https://www.webapteka.ru/drugbase/name7534.html
- http://lekhar.ru/lekarstva/dermatologicheskie-sredstva/okis-cinka-instrukcija-po-primeneniju/
- https://medside.ru/tsinka-okis
- https://chemege.ru/zink/
- https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/oksid-tsinka-harakteristika-svoystva-i-poluchenie-himicheskie-reaktsii/
- https://allmed.pro/drugs/cinka_okis

 portal-c.ru
portal-c.ru