Ферменты: общая характеристика, функции, виды и механизмы действия
Различные химические процессы – основа жизнедеятельности любого организма. Главная роль в них отведена ферментам. Ферменты или энзимы являются природными биокатализаторами. В организме человека они принимают активное участие в процессе переваривания пищи, функционировании центральной нервной системы и стимуляции роста новых клеток. По своей природе ферменты относятся к белкам, предназначенным для ускорения различных биохимических реакций в организме. Расщепление белков, жиров, углеводов и минералов – процессы, в которых энзимы выступают одними из основных действующих компонентов.
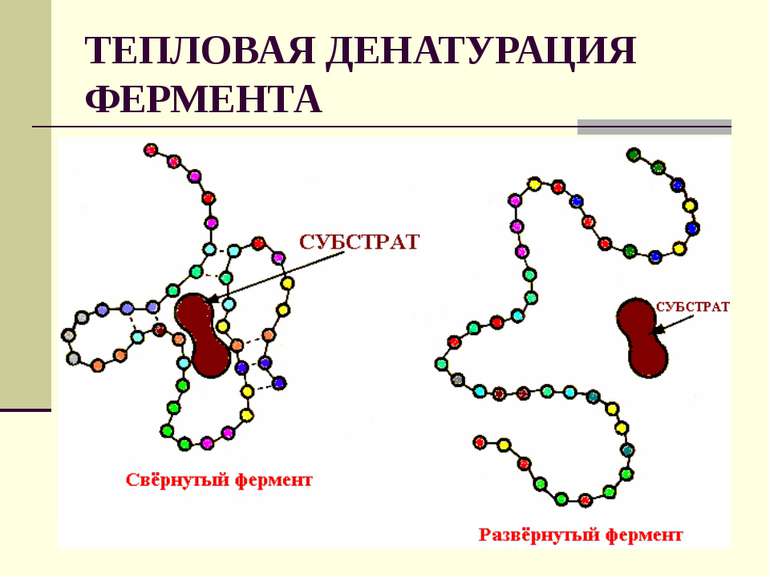
Существует довольно много разновидностей ферментов, каждая из которых предназначена для воздействия на то или иное вещество. Белковые молекулы уникальны и не способны заменять друг друга. Для их активности необходим определенный температурный диапазон. Для ферментов человека идеальной является нормальная температура тела. Кислород и солнечный свет разрушает ферменты.
Общая характеристика ферментов
Являясь органическими веществами белкового происхождения, ферменты действуют по принципу неорганических катализаторов, ускоряя реакции в клетках, в которых они синтезируются. Синоним к названию таких белковых молекул – энзимы. Почти все реакции в клетках происходят с участием специфических ферментов. В их составе выделяют две части. Первая представляет собой непосредственно белковую часть, представленную белком третичной структуры и именуемую апоферментом, вторая – активный центр энзима, получивший название кофермент. Последний может представлять собой органические/неорганические вещества, и именно он выступает основным «ускорителем» биохимических реакций в клетке. Обе части образуют единую белковую молекулу, названную холоферментом.
Каждый фермент предназначен для воздействия на конкретное вещество, именуемое субстратом. Результат произошедшей реакции называется продуктом. Названия самих ферментов довольно часто образуется на основе названия субстрата с добавлением окончания «-аза». К примеру, энзим, предназначенный для расщепления янтарной кислоты (сукцината), носит название сукцинатдегидрогеназа. Кроме того, название белковой молекулы определяется и типом реакции, выполнение которой она обеспечивает. Так, дегидрогеназы отвечают за процесс регенерации и окисления, а гидролазы – за расщепление химической связи.
Действие ферментов различных видов направлено на определенные субстраты. То есть участие белковых молекул в тех или иных биохимических реакциях индивидуально. Каждый фермент связан со своим субстратом и может работать только с ним. За неразрывность этой связи отвечает апофермент.
Ферменты могут пребывать в свободном состоянии в цитоплазме клетки или же взаимодействовать с более сложными структурами. Также существуют определенные их виды, действующие вне клетки. К ним относятся, например, ферменты, расщепляющие белки и крахмал. Кроме того, энзимы могут вырабатываться различными микроорганизмами.
Современная энзимология
Для изучения ферментов и процессов, происходящих с их участием, предназначена отдельная область биохимической науки – энзимология. Впервые информация об особых белковых молекулах, действующих по принципу катализаторов, появилась в результате изучения пищеварительных процессов и реакций брожения, происходящих в организме человека. Существенный вклад в развитие современной энзимологии приписывается Л. Пастеру, который считал, что все биохимические реакции в организме происходят при участии исключительно живых клеток. О неживых «участниках» таких реакций впервые было заявлено Э. Бухнером в начале ХХ ст. В то время исследователю удалось определить, что катализатором в процессе сбраживания сахарозы с последующим выделением этилового спирта и диоксида углерода выступает бесклеточный дрожжевой экстракт. Данное открытие стало решительным толчком для подробного изучения так называемых катализаторов различных биохимических процессов в организме.
Уже в 1926 году был выделен первый фермент – уреаза. Автором открытия стал Дж. Самнер, сотрудник Корнеллского университета. После этого в течение одного десятилетия учеными был выделен ряд других энзимов, а белковая природа всех органических катализаторов – доказана окончательно. На сегодняшний день миру известно свыше 700 различных ферментов. Но при этом современная энзимология продолжает активное изучение, выделение и изучение свойств отдельных видов белковых молекул.
Ферменты: белковая природа
Так же как и белки , ферменты принято делить на простые и сложные. Первые представляют собой соединения, состоящие из аминокислот, например, трипсина, пепсина или лизоцима. Сложные энзимы, как упоминалось выше, состоят из белковой части с аминокислотами (апофермента) и небелковой составляющей, получившей названием кофактора. Только сложные ферменты могут участвовать в биореакциях. Кроме того, подобно белкам ферменты бывают моно- и полимерами, то есть состоят из одной или нескольких субъединиц.
Общими свойствами ферментов как белковых структур являются:
- эффективность действия, подразумевающая значительное ускорение химических реакций в организме;
- избирательность к субстрату и типу выполняемой реакции;
- чувствительность к показателям температуры, кислотно-щелочного баланса и другим неспецифическим физико-химическим факторам среды, в которой действуют ферменты;
- чувствительность к действию химических реагентов и др.
Функции ферментов
Основная роль ферментов в организме человека – преобразование одних веществ в другие, то есть субстратов в продукты. Они выступают катализаторами свыше чем в 4 тысячах биохимических жизненно важных реакций. Функции ферментов заключаются в направлении и регуляции метаболических процессов. Как неорганические катализаторы, энзимы могут в разы ускорять прямую и обратную биореакцию. Стоит отметить, что при их действии химическое равновесие не нарушается. Происходящие реакции обеспечивают распад и окисление питательных веществ, попадающих в клетки. Каждая белковая молекула может выполнять огромное множество действий в минуту. При этом белок ферментов, вступая в реакцию с различными веществами, остается неизменным. Энергия, вырабатываемая в процессе окисления питательных веществ, используется клеткой так же, как и продукты расщепления веществ, необходимые для синтеза органических соединений.
Сегодня широкое применение нашли не только ферменты-препараты медицинского назначения. Энзимы также используются в пищевой и текстильной промышленности, в современной фармакологии.
Классификация ферментов
На собрании V Международного биохимического союза, прошедшем в Москве в 1961 году, была принята современная классификация ферментов. Данная классификация подразумевает их деление на классы, в зависимости от типа реакции, в которой энзим выступает катализатором. Кроме того, каждый класс ферментов делится на подклассы. Для их обозначения используется код из четырех чисел, разделенных точками:
- первое число обозначает механизм реакции, в которой фермент выступает катализатором;
- второе число указывает на подкласс, к которому принадлежит данный энзим;
- третье число – подкласс описываемого фермента;
- и четвертое – порядковый номер энзима в подклассе, к которому он принадлежит.
Всего в современной классификации ферментов выделяют шесть их классов, а именно:
- Оксидоредуктазы – энзимы, выступающие катализаторами в различных окислительно-восстановительных реакциях, происходящих в клетках. В данный класс входит 22 подкласса.
- Трансферазы – класс ферментов с 9 подклассами. В него входят энзимы, обеспечивающие реакции транспорта между разными субстратами, ферменты, принимающие участие в реакциях взаимопревращения веществ, а также обезвреживания различных органических соединений.
- Гидролазы – энзимы, разрывающие внутримолекулярные связи субстрата посредством присоединения к нему молекул воды. В данном классе насчитывается 13 подклассов.
- Лиазы – класс, в составе которого находятся только сложные ферменты. В нем насчитывается семь подклассов. Энзимы, относящиеся к данному классу, выступают катализаторами в реакциях разрыва С-О, С-С, С-N и прочих типов органических связей. Также ферменты класса лиазы участвуют в обратимых биохимических реакциях отщепления негидролитическим путем.
- Изомеразы – энзимы, выступающие катализаторами в химических процессах изомерных превращений, происходящих в одной молекуле. Как и к предыдущему классу к ним относятся только сложные ферменты.
- Лигазы, иначе именуемые синтетазами – класс, включающий шесть подклассов и представляющий энзимы, катализирующие процесс соединения двух молекул под воздействием АТФ.
Состав ферментов
Состав ферментов объединяет в себе отдельные области, отвечающие за выполнение конкретных функций. Так, в составе ферментов, как правило, выделяют активный и аллостерический центры. Последний, к слову, есть далеко не у всех белковых молекул. Активный центр представляет собой сочетание остатков аминокислот, отвечает за контакт с субстратом и выполнение катализа. Активный центр в свою очередь делится на две части: якорную и каталитическую. Энзимы, состоящие их нескольких мономеров, могут содержать более одного активного центра.
Аллостерический центр отвечает за активность ферментов. Свое название такая часть ферментов получила из-за того что его пространственная конфигурация не имеет ничего общего с молекулой субстрата. Изменение скорости реакции, происходящей с участием фермента, обуславливается связыванием различных молекул именно с аллостерическим центром. Энзимы, содержащие в своем составе аллостерические центры, являются полимерными белками.
Химическая природа и строение ферментов
Все ферменты — белки, имеющие, как и другие белки, первичную, вторичную, третичную и часто четвертичную структуру (см. Белки). Ферменты могут быть как простыми, так и сложными белками. Молекулы ферментов, представляющих собой простые белки, целиком построены из полипептидных цепей и при гидролизе распадаются только на аминокислоты. Примером ферментов такого рода являются гидролитические ферменты пепсин, трипсин (см.), уреаза, лизоцим (см.) и др. Большинство природных ферментов относится к сложным белкам, содержащим в составе своей молекулы помимо полииептидных цепей небелковый компонент. Как белковая часть такого сложного фермента (апо-фермент), так и небелковый компонент его молекулы (кофермент) в отдельности лишены ферментативной активности. Только соединившись вместе и образовав так называемый. холо-фермент, они приобретают свойства, характерные для биокатализаторов.
Ряд коферментов (см.) является производными витаминов (см.). По химическому строению многие коферменты представляют собой нуклеотиды, некоторые — органические производные фосфорной к-ты или пептиды и их производные (например, фолиевая кислота, Ко А, глутатион и др.). Таким образом, между ферментами, витаминами и нуклеотидами существует определенная функциональная связь.
Механизм действия ферментов и их специфичность
Для объяснения механизма действия ферментов было предложено много теорий. Все они исходят из экспериментально установленного факта, что биокатализаторы, так же как и неорганические катализаторы, не могут сделать возможным протекание процессов или реакций, которые с точки зрения законов термодинамики (см.) невозможны. Все теории катализа (см.) допускают, что катализаторы тем или иным путем снижают энергию активации катализируемой реакции и таким образом резко увеличивают скорость химического превращения. Катализаторы лишь сокращают время, необходимое для достижения химических реакций (см. Химические реакции) состояния подвижного равновесия. Состояние подвижного равновесия обратимой хим. реакции в присутствии катализатора становится стационарным. Следовательно, при наличии катализатора в равной мере возрастает скорость как прямой, так и обратной реакции.
Начало современным представлениям о механизме действия ферментов было положено работой Михаэлиса (L. Michaelis) и Ментен (М. L. Menten), опубликованной в 1913 году. В этой работе впервые высказывалась идея, что основой действия ферментов является образование фермент-субетратного комплекса, который затем распадается с образованием продуктов ферментативной реакции и освобождением ферментов в исходном состоянии.
В процессе образования и превращениях фермент-субстратных комплексов принято различать несколько стадий: 1) присоединение молекулы субстрата к ферменту; 2) последовательное превращение первичного фермент-субстратного комплекса в один или несколько активированных комплексов; 3) отделение конечных продуктов реакции от фермента.
Специфичность, которую проявляют ферменты в отношении субстрата как при образовании фермент-субстратного комплекса, так и при каталитическом химическом превращении, обусловлена существованием в молекуле фермента специфического участка, называемого активным центром. Та часть активного центра, к-рая принимает непосредственное участие в каталитическом действии, получила название каталитического участка, а место, где осуществляется связывание фермента с субстратом — контактного участка, или контактной площадки. К 80-м годам 20 века был идентифицирован аминокислотный состав активных центров многих ферментов. В активный центр фермента могут входить аминокислотные остатки, сравнительно далеко отстоящие друг от друга в полипептидной цепи и сблизившиеся в результате ее «перекручивания» при образовании вторичной и третичной структур ферментного белка. Так, в молекуле химотрипсина (см.) в состав активного центра входят остаток гистидина, находящийся в полипептидной цепи в положении 57, остаток серина в положении 195 и остаток аспарагиновой к-ты в положении 102.
Расположение аминокислотных остатков, формирующих контактный участок в молекуле фермента, способствует такому пространственному размещению субстрата, которое наиболее благоприятно для его атаки каталитическими (функциональными) группами активного центра. Напр., реакция А + В —> АВ, катализируемая соединениями, имеющими активные группы С, D и Е, в обычных условиях должна была бы происходить только в том случае, если бы одновременно столкнулись все пять реагентов. Вероятность такого столкновения ничтожно мала, поэтому скорость образования продукта реакции АВ в этом случае практически равна нулю. В том случае, если эту реакцию катализирует фермент, требуется только его взаимодействие с веществами А и В, поскольку группы С, D и Е уже «вмонтированы» в молекулу фермента. В результате эффекта близости реакционных групп в молекуле скорость катализируемой ферментом реакции увеличивается на несколько порядков. Кроме того, когда субстрат присоединяется к активному центру фермента пространственная конфигурация молекулы субстрата изменяется и определенные хим. связи в ней ослабевают.
Каталитическая активность фермента определяется структурой его молекулы в целом. Другие аминокислотные остатки, помимо входящих в активный центр, необходимы для формирования и стабилизации определенной конформации активного центра (см. Конформация), они также образуют участки, с которыми специфически взаимодействуют различные вещества, регулирующие активность фермента. В молекуле фермента имеются такие участки, за счет которых он может взаимодействовать с другими ферментами (при образовании мультиферментных комплексов) или белками мембран (мембранные ферменты).
Важнейшим свойством ферментов является их субстратная специфичность, то есть способность не только ускорять реакции, но и избирательно катализировать лишь определенный путь превращения конкретного вещества — субстрата. По признаку специфичности действия все ферменты можно разделить на две группы: ферменты, обладающие абсолютной специфичностью, и ферменты, обладающие относительной специфичностью. Абсолютная специфичность проявляется тогда, когда ферменты действует лишь на одно единственное вещество и катализирует только определенное превращение этого вещества. Например., уреаза катализирует только одну реакцию — гидролиз мочевины (см.), то есть ее расщепление на аммиак NH3 и диоксид углерода CO2. К абсолютной специфичности относят также стереохимическую (оптическую) специфичность (см. Изомерия). В живой природе встречаются лишь определенные пространственные формы соединений: аминокислоты (см.) — в белках только L-ряда, сахара — преимущественно D-ряда. Ферменты всегда действуют только на один из двух оптических изомеров вещества (L- или D-изомер). Например, ЛДГ катализирует окисление только L-лактата. Специфичность фермента может быть направлена и на другие типы стереоизомеров. Так, ферменты, действующие на транс-изомер, обычно неактивны в отношении цис-изомера этого же вещества.
Наряду с ферментами, которым свойственна абсолютная специфичность, имеется большая группа ферментов, обладающих относительной или групповой специфичностью. Например, пепсин катализирует расщепление белковых молекул, которые могут существенно отличаться друг от друга как по аминокислотному составу, так и по физико-химическим свойствам. Объясняется это тем, что местом действия пепсина является пептидная связь —СО—NH —. Относительной специфичностью обладают также эстеразы (см.). Для их действия важно наличие в молекуле субстрата сложноэфирной связи. Однако существуют эстеразы, действующие более избирательно. Так, для фосфатаз (см.) важно, чтобы в образовании сложного эфира участвовала ортофосфорная кислота (см. Фосфорные кислоты).
Кинетика ферментативных реакций
Скорость ферментативной реакции зависит прежде всего от природы фермента, который может обладать низкой или высокой ферментативной активностью, а также от концентрации субстрата, величины pH среды, температуры, присутствия ингибиторов или активаторов и др. (см. Кинетика биологических процессов). Установлено, что при прочих равных условиях и при наличии избытка субстрата начальная скорость ферментативной реакции пропорциональна концентрации фермента.
Зависимость между концентрацией субстрата и скоростью ферментативной реакции графически можно выразить кривой, показанной на рисунке. Скорость реакции, соответствующая восходящей части кривой, пропорциональна концентрации субстрата (S); в верхней части кривой скорость реакции приближается к максимальному значению (vМакс) и почти не зависит от концентрации субстрата. Исходя из представлений об образовании фермент-субстратных комплексов в ходе ферментативной реакции, Михаэлис и Ментен рассчитали весьма важную константу, позже названную константой Михаэлиса (Км), которая в числовом выражении равна той концентрации субстрата (моль/л), при которой скорость реакции составляет половину максимальной (то есть когда в любой момент в комплексе с субстратом находится половина молекул фермента). Таким образом, Км является мерой сродства между ферментом и субстратом, причем низкие величины Км свидетельствуют о высокой степени такого сродства.
Существует еще одна величина, характеризующая ферментативную реакцию, которая получила название «число оборотов фермента». Величина эта показывает, сколько молекул субстрата превращается в продукты реакции за единицу времени в расчете на одну молекулу фермента.
Ферментативные реакции, подобно обычным химическим реакциям, ускоряются при повышении температуры. Установлено, что повышение температуры на каждые 10° увеличивает скорость ферментативной реакции в 1,5 — 2 раза (такая закономерность для большинства ферментов проявляется в интервале от 10 до 30°). Показано также, что возрастание температуры на 1° повышает активность фермента на 4—10%. Однако при температуре 50° и выше происходит постепенное снижение активности фермента. Дальнейшее нагревание (до 60—70°) приводит к постепенной денатурации и инактивации фермента. Степень инактивации зависит также от длительности температурного воздействия.
Ферменты весьма чувствительны к изменениям величины рН среды. Каждый фермент имеет оптимум pH, при к-ром он наиболее активен. Для большинства ферментов оптимальная величина pH близка к нейтральной (pH 7,0). Таким образом, максимальная активность фермента проявляется при физиологических значениях pH, а в кислой и щелочной среде их активность снижается. Из этого правила, впрочем, имеются исключения. Например, пепсин, содержащийся в желудочном соке (см.), активен лишь в очень кислой среде (pH около 2,0), а трипсин (см.) при этих значениях pH полностью ингибируется. Оптимум действия трипсина лежит при pH около 8,0, то есть в щелочной среде.
Кроме температуры, величины pH среды, концентрации субстрата большое влияние на активность фермента оказывает присутствие ряда хим. соединений. Одни из них повышают активность фермента, другие, напротив, подавляют ее. Иногда, впрочем, соединения, являющиеся ингибиторами для одних ферментов, могут быть активаторами для других (чаще всего это относится к ионам металлов). Процесс ингибирования фермента может быть обратимым и необратимым. Различают также конкурентное и неконкурентное ингибирование ферментативных реакций. Конкурентное ингибирование возникает тогда, когда в среде одновременно присутствуют субстрат и сходный с ним по структуре ингибитор (структурный аналог субстрата). В этом случае субстрат и ингибитор конкурируют за активный центр фермента. Тормозящее действие конкурентного ингибитора на фермент зависит от концентрации субстрата. Если в окружении фермента находится много молекул субстрата и мало молекул ингибитора, то во взаимодействие с активным центром фермента значительно чаще вступает субстрат. В этом случае ферментативная реакция не прекращается, а лишь замедляется. Если в инкубационной среде создать избыток субстрата, то конкурентное ингибирование прекращается. В случае неконкурентного торможения ингибитор не имеет структурного сходства с субстратом. Поэтому повышение концентрации субстрата не может привести к вытеснению ингибитора из комплекса фермент—ингибитор, как это происходит при конкурентном торможении. Примером неконкурентного торможения может служить действие цианистых соединений на цитохромоксидазу (см. Цитохромы).
Наряду с ингибиторами фермента существуют также их активаторы. Весьма часто роль активаторов выполняют ионы металлов. Нередко действие иона металла в качестве активатора заключается в связывании субстрата с ферментом. В ряде случаев действие ионов металлов абсолютно специфично, то есть для активации данного фермента требуется наличие определенного иона. Однако имеются ферменты, способные в одинаковой степени активироваться одними и теми же ионами металлов. Ион металла может являться постоянным компонентом активного центра фермента. Такие ферменты получили название истинных металлоферментов (см. Металлопротеиды). В других случаях ион металла не связан постоянно с ферментом и может функционировать только как мостик между ферментом и субстратом. В этом случае образование фермент-субстратного комплекса идет ступенеобразно. Чаще сначала ион металла соединяется с ферментом, а затем уже возникает комплекс фермент— металл—субстрат.
В качестве активаторов ферменты могут выступать также цистеин (см.), восстановленный глутатион (см.), мер-каптоэтанол и другие вещества, содержащие свободные SH-группы (см. Сульфгидрильные группы). Активирующий эффект подобных соединений заключается в том, что они восстанавливают дисульфидные связи (—S—S-связи) неактивного фермента с образованием свободных SH-групп, которые необходимы ферментам для проявления его каталитической активности.
Другим примером активации является превращение неактивных предшественников ферментов (проферментов, или зимогенов) в активные ферменты. В этом случае в основе активации лежит гидролиз одной или нескольких пептидных связей в молекуле профермента под действием протеолитических ферментов. Так, в состав полипептидной цепи профермента трипсина — трипсиногена входят 229 аминокислотных остатков. В результате гидролиза пептидной связи между 6-м и 7-м аминокислотными остатками от полипептидной цепи трипсиногена отщепляется N-концевой гексапептид, после чего создаются условия для формирования активного центра трипсина.
Единицы активности ферментов
Определение количественного содержания фермента в биологических объектах представляет известные трудности, поскольку за редким исключением ферментов в тканях присутствуют в ничтожно малых концентрациях. Поэтому непосредственно определяют не концентрацию фермента, а его активность. Об активности фермента судят по скорости ферментативной реакции, то есть по скорости убыли субстрата или по скорости образования продуктов реакции.
Международный биохимический союз рекомендовал международную единицу активности фермента (ME). Одна международная единица соответствует тому количеству фермента, к-рое катализирует превращение 1 мкмоль субстрата за 1 мин. в оптимальных для этого фермента условиях. Однако ME не может считаться единицей системы СИ, так как минута является внесистемной единицей.
Единицей активности ферментов в СИ является катал (кат) и его производные (мкат и др.). Один катал — это количество фермента, которое необходимо для каталитического превращения одного моля субстрата за 1 сек. Активность фермента в сыворотке крови в соответствии с системой СИ выражается в каталах и его долях на литр.
Внутриклеточная регуляция ферментативной активности
Простейший тип регуляции ферментативной активности, то есть регуляции метаболических процессов, затрагивает основные параметры, влияющие на скорость ферментативной реакции (pH среды, температура, концентрация субстрата и коферментов, присутствие ингибиторов и активаторов). Например, любой процесс, способный изменить реакцию среды внутри клетки, может влиять на скорость той или иной ферментативной реакции. Если в норме концентрация субстрата в клетке ниже значения константы Михаэлиса, то скорость ферментативной реакции будет резко изменяться в зависимости от содержания субстрата.
Другой общий путь регуляции метаболических процессов обеспечивается действием так называемых аллостерических ферментов. Важные представления о механизме этого явления были сформулированы французскими исследователями Ф. Яхакобом, Моно (J. L. Monod) и Шанже (J. P. Changeux) в 1963 году. Они постулировали положение, согласно которому снижение или повышение активности ферментов in vivo обычно является следствием изменения стерической конфигурации — конформации (см.) молекул фермента в результате присоединения соответствующих ингибиторов или активаторов, в роли которых выступают различные метаболиты, к другим, некаталитическим участкам ферментов. Эти участки получили название аллостерических, или регуляторных, центров (греческий alios иной, другой). В результате присоединения ингибитора к аллостерическому центру фермента взаимодействие его активного центра с субстратом становится невозможным, несмотря на то что активные группировки в каталитическом участке фермента остаются не блокированными. Напротив, под влиянием аллостерического активатора происходят такие изменения конфигурации активного центра, которые приводят к повышению каталитической активности фермента.
Третьим типом регуляции ферментативной активности является изменение концентрации фермента в результате стимулирования или ингибирования его биосинтеза либо изменения скорости его катаболизма. Существует также регуляция ферментативной активности с помощью взаимозаменяемых форм ферментов. Например, фосфорилаза мышечной ткани, катализирующая расщепление гликогена (см.) до глюкозо-1-фосфата (см. Фосфорилазы), может существовать в двух формах — a и b. Молекула фосфорилазы а состоит из четырех идентичных субъединиц, а фосфорилазы b — из двух. В физиологических условиях фактически активной формой является преимущественно фосфорилаза. Под влиянием ряда гормонов и при участии аденилатциклазной системы фосфорилаза b способна превратиться в фосфорилазу.
Выделение и очистка ферментов. В клетках животных, микроорганизмов, растений, в биологических и культуральных жидкостях ферменты находятся в сложной по химическому составу смеси. Для выделения и очистки ферментов с целью изучения их свойств, роли в регуляции обмена веществ и энергии (см.), применения в диагностических или лечебных целях пользуются различными методами и приемами. Какой-либо стандартной, универсальной схемы выделения и очистки фермента нет и не может быть, так как структурные и физико-химические различия ферментов чрезвычайно велики. Вместе с тем можно отметить определенную общность в методическом подходе к разработке конкретных методов выделения и очистки ферментов.
Если речь идет о клеточном ферменте, то прежде всего необходимо разрушить клетки и перевести фермент в раствор. Для этого клеточную оболочку можно разрушить замораживанием и оттаиванием клеточной массы, гомогенизацией, растиранием с измельченным стеклом или порошком окиси алюминия, действием ультразвука и другими специальными методами. Например, в некоторых случаях целесообразна обработка клеток ацетоном, при этом клеточные стенки разрушаются, биомасса обезвоживается, а ферменты остаются в составе сухого порошка, из которого их экстрагируют буферным раствором.
Независимо от способа разрушения клеток первичный экстракт, содержащий фермент, обычно представляет собой суспензию разрушенных клеток в буферном растворе, часто содержащем добавки различных солей, антиоксидантов и других веществ.
На следующем этапе очистки фермента эту суспензию центрифугируют для того, чтобы отделить неразрушенные клетки, обрывки клеточных оболочек, а в ряде случаев ядра, митохондрии и другие клеточные органеллы. Надосадочная жидкость, полученная после центрифугирования, содержит сложную смесь фермента, структурных белков, нуклеиновых кислот, полисахаридов и других соединений. Для удаления балластных веществ, например, нуклеиновых кислот, используют их осаждение стреитомицинсульфатом, иротаминсульфатом, полиэтиленимином, для удаления примесных белков — их осаждение сернокислым аммонием, органическими растворителями (ацетоном, изопропанолом, этанолом и др.), а также термическую обработку или обработку кислотой и другие воздействия. Для удаления низкомолекулярных соединений применяют диализ (см.) или фильтрацию через интактные, химически инертные, диспергированные в стеклянной колонке гелеобразные наполнители декстрановой природы (см. Гельфильтрация), например, сефадексы G-10, G-15, G-25.
Для большинства ферментов этих приемов очистки недостаточно, и тогда на последующих стадиях выделения используют более тонкие методы фракционирования — электрофорез (см.), изоэлектрофокусировку (см. Изоэлектрическая точка), ионообменную хроматографию (см.), аффинную хроматографию и др.
Ферменты и клиническая медицина
Можно выделить три главных направления исследований ферментов, имеющих непосредственное отношение к клинической медицине. Это — энзимодиагностика, энзимопатология (см. Энзимопатии) и энзимотерапия (см.).
Энзимодиагностика — использование определения активности ферментов в целях диагностики. Из биохимических диагностических методов, применяемых в клинике, ферментативные тесты являются наиболее чувствительными и специфичными. Интерес к исследованию активности ферментов в диагностических целях не ограничивается определением их величины в сыворотке крови. Определение активности ряда ферментов проводят в моче, цереброспинальной, семенной, синовиальной и других жидкостях; в эритроцитах, лейкоцитах и тромбоцитах активность некоторых ферментов определяют прежде всего при диагностике болезней крови. Нередко важное диагностическое значение, особенно при наследственных заболеваниях, имеет изучение активности ферментов в материале, полученном при биопсии.
В клинике при исследовании активности ферментов в сыворотке (плазме) крови удается обнаружить два типа изменений — повышение активности ферментов, или гиперферментемию, которая обычно обусловлена нарушениями внутриклеточной организации ферментов и патологической проницаемостью клеточных мембран, и понижение активности постоянно присутствующих в крови ферментов, или гипоферментемию, которая может быть связана с генетически обусловленными дефектами ферментов или с воздействием ингибиторов и других понижающих активность ферментов агентов.
Скорость высвобождения различных ферментов из поврежденных тканей зависит от нескольких факторов. Одним из них является так наз. концентрационный градиент (см. Градиент), который неодинаков для различных ферментов и типов клеток. Активность ферментов внутри клеток в норме превышает их активность во внеклеточной жидкости в тысячи и десятки тысяч раз. Другим фактором, определяющим скорость выхода фермента из клетки, является размер его молекул, их относительный мол. вес (масса). Третий фактор — это внутриклеточная локализация ферментов, их интеграция с определенными клеточными структурами.
В практике работы различных клинико-диагностических лабораторий находят применение свыше 100 ферментных тестов, но наиболее часто из них используют определение активности асиартатаминотранеферазы (Ас АТ), аланинаминотрансферазы (АлАТ), креатинфосфокиназы (КФК), лактатдегидрогеназы (ЛДГ), глута-матдегидрогеназы (ГлДГ), сорбитол-дегидрогеназы (СДГ), щелочной и кислой фосфатаз (ЩФ и КФ), гамма-глутамилтрансферазы (Г-ГТФ), лейцинаминопептидазы (ЛАП), холинэстеразы (ХЭ) и амилазы.
Своевременное определение активности ряда ферментов в сыворотке крови обеспечивает раннюю диагностику острого инфаркта миокарда, вирусного гепатита, панкреатита, нефрита и нефроза, системных заболеваний крови и др. Об эффективности и надежности энзимодиагностики судят по двум критериям — чувствительности ферментного теста и его специфичности. Чувствительность теста считается хорошей, если уровень активности ферментов в сыворотке крови, определяемый с его помощью, при патологии всегда превышает норму. Специфичность ферментного теста считается высокой, если определяемая с его помощью активность фермента в сыворотке крови изменяется только при каком-либо одном заболевании или небольшой группе болезней. Однако пока большинство ферментных тестов, заключающихся в определении общей активности какого-либо фермента в сыворотке крови, мало специфично в этом отношении.
Энзимопатология — изучение изменений активности ферментов при патологических состояниях и выяснение их роли в патогенезе заболеваний. Прежде интересы энзимопатологии ограничивались строго определенным кругом наследственных заболеваний, получивших название энзимопатий. Известны сотни различных наследственных болезней (см.), обусловленных врожденным дефектом обмена веществ вследствие ферментных нарушений. К таким болезням относятся многочисленные гликозидозы (см. Гликозидозы), липидозы (см.), гликогенозы (см.), генетически обусловленные нарушения обмена аминокислот — фенилкетонурия (см.) и др.
Однако ферментные спектры в тканях изменяются не только при наследственных болезнях, но и при большинстве других заболеваний. В связи с этим в 1969 году А. А. Покровский предложил новое определение энзимопатий, под которыми он понимал любые стойкие изменения ферментных спектров органов и тканей, приводящие к развитию патологического процесса. Согласно классификации энзимопатий, по А. А. Покровскому, существуют следующие их виды: наследственные энзимопатии, алиментарные энзимопатии, энзимопатии, вызванные нарушениями нейрогуморальной регуляции, токсические энзимопатии, энзимопатии, связанные с нарушениями внутриклеточной организации ферментных процессов.
Применение ферментов и регуляторов их действия (активаторов и ингибиторов) в качестве лекарственных средств составляет содержание энзимотерапии. К 80-м годам 20 века в клинике с лечебной целью использовали более 50 различных ферментных препаратов (см.). Так, при расстройствах пищеварения широко применяют кристаллические препараты пепсина в качестве средства заместительной терапии. Весьма важным и перспективным является использование трипсина и химотрипсина в качестве противовоспалительных противоотечных средств и средств, облегчающих удаление вязких секретов и экссудата при воспалении. В клинике все шире стали применять препараты гиалуронидазы (см.) — лидазу, ронидазу, имеются рекомендации по использованию коллагеназы (см.). В качестве фибринолитических средств назначают препарат фибринолизин (см.), а также стрептодеказу — препарат стрептокиназы (КФ 3.4.99.22) и др. (см. Фибрино-литические средства).
С лечебной целью применяют не только сами ферменты, но и их ингибиторы и активаторы. Естественные ингибиторы пептид-гидролаз (см.) с успехом используют в терапии острого панкреатита, артритов, аллергических заболеваний. В качестве лекарственных средств назначают ингибиторы карбоангидразы (см.), моноаминоксидазы (см.) и других ферментов. Большие перспективы открывает клиническое использование ингибиторов фермента пептидилдипептидазы (КФ 3.4.15.1), который способен координировать действие кининовой и ренин-ангиотензинной систем (см. Кинины) и, следовательно, участвовать в регуляции сосудистого тонуса. С лечебной целью используют так называемые антиферментные вещества— лекарственные средства, избирательно подавляющие активность определенных ферментов.
Новое перспективное направление связано с использованием иммобилизованных ферментов. Такие формы ферментных препаратов характеризуются полностью сохраненной каталитической активностью соответствующего фермента, однако действие иммобилизованного фермента в организме более длительно, а антигенность ферментного белка снижена. Сравнительно недавно получены иммобилизованные ферментные препараты фибринолитического действия. В частности, иммобилизованная водорастворимая стрептодеказа оказывает выраженное положительное терапевтическое действие при эмболии легочных артерий и тромбозе коронарных сосудов.
Гистохимические методы определения ферментов в тканях
Ферменты можно изучать с помощью как химических, так и гистохимических методов. Последние позволяют исследовать ферменты в нормальных и патологически измененных органах, тканях и клетках, не прибегая к предварительному разрушению (напр., гомогенизации) исследуемого объекта. Гистохимия ферментов служит связующим звеном между их морфологией и биохимией.
Ферменты катализирует метаболические реакции, преобразуя субстрат. Именно на этом основано большинство гистохимических методов выявления ферментов. Другой подход основан на белковой природе ферментов и базируется на иммуно-гистохимических методах. Существуют и авторадиографические методы выявления ферментов, связанные с использованием специфических меченых ингибиторов. При гистохимическом выявлении ферментов важно получить и сделать видимым продукт ферментативной реакции в месте локализации ферментов. При этом структура тканей и клеток должна быть достаточно хорошо сохранена, что необходимо для установления точной локализации ферментов и оценки ферментативной активности, особенно при электронно-микроскопическом исследовании.
При гистохимическом определении ферментов следует как можно более точно соблюдать следующие требования. Подготовка тканей и срезов не должна влиять на распределение и активность исследуемого фермента. Субстрат и вспомогательные реагенты инкубационной среды должны проникать во все клетки и их компоненты с одинаковой скоростью и не препятствовать проявлению ферментативной активности. Необходимо, чтобы субстрат по возможности расщеплялся только одним ферментом, а продукт ферментативной реакции вспомогательные реагенты улавливали очень быстро и независимо от окружающей клетку среды. Требуется, чтобы конечный продукт реакции моментально осаждался и был практически нерастворимым в водных растворах и липидах, имел аморфное или микрокристаллическое строение и оставался стабильным. Вещества, участвующие в реакции, не должны связываться или адсорбироваться с какими-либо структурами, помимо ферментативно активных. Обычно все эти требования удовлетворить довольно трудно, поэтому для каждой гистохимической реакции подбирают компромиссное сочетание требуемых условий.
Гистохимические методы выявления ферментов, связанные с их действием на субстрат, основаны на нескольких типах реакций.
Реакции осаждения включают несколько вариантов. Осаждение продукта ферментативного расщепления субстрата ионами металлов с последующим проявлением образующегося комплекса в виде окрашенного продукта реакции в месте локализации ферментов используется при выявлении фосфатаз, сульфатаз, холинэстеразы; метод одновременного сочетания, при к-ром продукт ферментативного расщепления субстрата вступает в реакцию с сочетающим агентом с образованием нерастворимого красителя, применяется при выявлении фосфатаз, гликозидаз, карбоксилэстераз и пептид-гидролаз; эти же ферменты выявляются с помощью индигогенных методов, при которых в результате реакций расщепления и осаждения образуется синее индиго. Тетразолиевые методы, основанные на образовании формазанов в результате ферментативного окисления субстрата и восстановления соли тетразолия (см. Тетразолия соли), используются для выявления оксидоредуктаз, гексокиназы, альдолазы и других ферментов.
Реакции последовательного сочетания проводят в две стадии: в одной среде идет ферментативное расщепление субстрата с образованием нерастворимого продукта, в другой — реакция сочетания этого продукта для его визуализации с соответствующим агентом; эти реакции применяют при выявлении фосфатаз (см.) гликозидаз и других ферментов.
Реакции синтеза, используемые при выявлении некоторых трансфераз, протекают в две стадии и включают синтез из растворимого субстрата нерастворимого вещества, к-рое делается видимым с помощью другой, специальной реакции.
Реакции с использованием субстратной пленки, содержащей субстрат или состоящей из него, заключаются в том, что на пленку накладывают срез, фермент расщепляет соответствующий субстрат, после чего субстрат окрашивают, места локализации фермента при этом остаются неокрашенными. Этот метод служит для выявления протеаз (см. Пептид-гидролазы), нуклеаз (см.), амилаз (см.).
С помощью гистохимических методов получают информацию о локализации и активности ферментов в тканевых срезах. Однако во время подготовки срезов ферментативная активность может значительно снижаться. Кроме того, в процессе фиксации частично или полностью отмываются или диффундируют из ткани в инкубационную среду те ферменты, которые непрочно прикреплены к мембранным структурам, следовательно, с помощью обычных гистохимических методов можно обнаруживать только ферменты, прочно связанные с клеточными структурами или вторично иммобилизованные в результате фиксации ткани. Для гистохимического выявления растворимых ферментов существуют специальные методы, основанные на иммобилизации ферментов в месте их локализации.
Главная цель гистохимических методов обнаружения ферментов — прежде всего установление места их точной локализации, при этом не столь важно, что иногда не соблюдаются оптимальные условия для протекания ферментативных реакций, например, при избранной концентрации субстрата не обеспечивается кинетика реакций нулевого порядка или реакцию приходится проводить при неоптимальных значениях pH и др. Однако при количественных гистохимических исследованиях необходимо не только точно установить локализацию разных ферментов, но и определить различия в их активности, поэтому в данном случае концентрация субстрата, толщина срезов, время инкубации имеют решающее значение. Количественные измерения в процессе гистохимических исследований ферментов возможно производить при наличии инкубационных сред, позволяющих обнаруживать истинные локальные различия в степени активности ферментов без существенных ее потерь. Эти измерения проводят с помощью цитофотометрии (см.), микроденситометрии (см. Денситометрия), интерференционной микроскопии (см. Микроскопические методы исследования) и других способов. Мерой ферментативной активности может служить точное время инкубации, необходимое для образования микроскопически регистрируемого продукта реакции в определенных сравниваемых участках среза, а также другие параметры, например, степень поглощения проходящего света определенной длины волны и др.
Процедура гистохимического выявления ферментов состоит из ряда этапов: взятия сфобы, последующей обработки, инкубации. После взятия пробы ткань следует обрабатывать с максимальной быстротой, так как в результате аутолитических процессов с течением времени локализация и активность ферментов изменяются. Объем и количество материала определяются задачами исследования, характером подготовки, видом органа.
Этапы дальнейшей обработки зависят от изучаемого фермента, задачи исследования, метода выявления. Ферменты, чувствительные к фиксации (большинство дегидрогеназ, трансферазы, цитохромоксидаза, лиазы), лучше изучать на нефиксированных тканях. Другие ферменты (тетразолий-редуктазы, многие гидролазы, некоторые пероксидазы) проявляют относительную устойчивость при фиксации и, следовательно, могут быть обнаружены в фиксированном материале. Многие ферменты растворимы, поэтому должны быть приняты меры против их перехода в инкубационный раствор. С этой целью используют гелевые среды или полупроницаемые мембраны, которые действуют как диффузионный барьер.
Задачи исследования и выбранный метод определяют особенности последующей обработки. При использовании нефиксированной ткани для получения срезов ее предварительно замораживают. В результате замораживания мгновенно прекращаются метаболические процессы, аутолиз, диффузия ферментов и др. Замораживание необходимо проводить очень быстро и при низких температурах (не выше — 70°), чтобы избежать образования кристаллов льда, разрушающих клетки. Для замораживания используют жидкую углекислоту (диоксид углерода), жидкий азот, пропан, охлажденный жидким азотом, петролейный эфир, гексан или гептан, охлажденные смесью ацетона и сухого льда. Срезы из замороженной нефиксированной ткани следует делать в криостате, а затем помещать на предметные или покровные стекла или на полупроницаемые мембраны. Методы замораживания — высушивания и замещения в замороженном состоянии тканевых блоков технически достаточно сложны, требуют много времени и в ряде случаев дают худшие результаты, чем замораживание — высушивание криостатных срезов. Последнее обеспечивает сохранность структур и возможность выявления практически всех ферментов, доступных определению гистохимическими методами.
Фиксацию применяют преимущественно при исследовании внутриклеточной локализации ферментов. С этой целью обычно используют альдегиды (см.) и их смеси, фиксацию ткани проводят как в блоках, так и в срезах. Фиксация в ацетоне с последующей заливкой в парафин пли целлоидин не рекомендуется. При фиксации в формальдегиде или глутаральдегиде, используемых наиболее часто, результаты (ферментативная активность, сохранность морфологической структуры) зависят от концентрации и чистоты альдегида, типа растворителя, величины pH, времени фиксации, температуры. Раствор формальдегида следует готовить из параформальдегида без добавления муравьиной кислоты и метанола, имеющихся в коммерческом формальдегиде. Раствор глутаральдегида необходимо периодически очищать от примесей, например, путем фильтрации через животный уголь. Чувствительность различных ферментов к фиксации колеблется в широких пределах, и это необходимо учитывать в каждом конкретном случае. Для повышения остаточной активности ферментов ткань после фиксации следует тщательно промыть. Эта процедура повышает остаточную активность фермента в 2 — 3 раза. Для промывания используют проточную или дистиллированную воду, различные буферные растворы, физиологический раствор, раствор сахарозы. Отдельные ферменты по-разному выдерживают промывание: активность некоторых из них возрастает с увеличением времени промывания (таковы кислая фосфатаза, арилсульфатаза, НАДН-тетразолий-редуктаза), в этих случаях ткань можно хранить в промывочной жидкости при 4° по меньшей мере 1 неделю. Активность других ферментов возрастает только в начале промывания, а при его продолжении снижается (напр., у щелочной фосфатазы, АТФ-азы). Методика замораживания фиксированных тканевых блоков для получения срезов в криостате или (реже) на замораживающем микротоме в принципе не отличается от методики замораживания нефиксированной ткани, за исключением того, что скорость замораживания фиксированных тканевых блоков не имеет существенного значения. Температура замораживания колеблется от —10° до —30 в зависимости от вида жидкости, использованной для промывания. Склонность срезов некоторых органов с гетерогенной структурой (кожа, селезенка и др.) к распаду можно предотвратить предварительным пропитыванием тканевых блоков после промывания глицерин-желатиной.
В блоках ткани, залитых в парафин, при соблюдении ряда условий, можно параллельно с получением постоянно окрашенных гистологических препаратов выявить некоторые ферменты: щелочную фосфатазу, пептидгидролазы, глюкамилазы в щеточной каемке; эстеразы в эндоплазматическом ретикулуме и лизосомах; p-N-ацетилглюкозаминидазу, Р-глюкуронидазу в клетках с высокой физиологической активностью.
Ответственными этапами гистохимической идентификации ферментов являются инкубация, заключающаяся в выдерживании срезов в среде, содержащей субстрат и вспомогательные реагенты, и приготовление препарата, пригодного для микроскопического исследования. Инкубацию проводят, как правило, при 37°. Ткани с высокой ферментативной активностью следует инкубировать при комнатной температуре во избежание избыточного образования продукта реакции и его диффузии. Гистохимическое выявление растворимых ферментов также проводят при комнатной температуре. Иногда требуется инкубация при 4°, особенно при выявлении кислых гидролаз, пептид-гидролаз, лактазы, что снижает неспецифическую фоновую окраску. При инкубации используют свободноплавающие срезы либо срезы, прикрепленные к предметному или покровному стеклу, в случае необходимости срезы могут быть помещены на полупроницаемые мембраны. Как правило, инкубацию продолжают до получения удовлетворительной положительной реакции в исследуемых клетках и тканях. Этот момент легко определить при применении методик прямого выявления ферментов (метод одновременного сочетания, индигогенные и тетразолиевые методы). При использовании методов непрямого выявления ферментов (методы с применением солей металлов, последовательного сочетания, реакции синтеза, большинство методов с субстратными пленками) развитие реакции не поддается визуальному контролю. в этих случаях нужно инкубировать одновременно несколько срезов и проявлять их через различные интервалы времени.
Общие принципы гистохимических выявления ферментов с помощью светового микроскопа, изложенные выше, лежат в основе многочисленных методов и электронно-микроскопического обнаружения ферментов (см. Электронная микроскопия). Особенность электронно-микроскопического выявления ферментов заключается в необходимости получения продукта гистохимической реакции, непроницаемого или мало проницаемого для электронов, что дает электронно-плотный осадок. Если сразу образуется нерастворимый продукт реакции, то в случае его достаточной электронной плотности он может непосредственно служить ультраструктурным маркером места нахождения ферментов, в противном случае приходится путем специальной обработки с использованием осмиофильных реагентов переводить продукт реакции в электронно-плотное соединение. Однако чаще инкубационная среда содержит прецииитирующий металлический реагент, посредством к-рого продукт ферментативного расщепления тотчас же превращается в выпадающую в осадок соль металла, хорошо видимую при ультраструктурном исследовании благодаря высокой электронной плотности.
Ферменты в судебно-медицинском отношении
Качественные и количественные исследования ферментов нашли широкое применение в судебной медицине при проведении научных исследований, а также в экспертной практике. В наиболее полной мере это относится к дифференцированному определению общей и тканеспецифической активности ферментов, а в ряде случаев и количества ферментных белков (цитохромы Р-450 и Р-420) для судебно-медицинского установления срока давности наступления смерти. При этом применяют как определение активности одного какого-то фермента в органах, для которых характерны различные сроки переживания прекращения сердечной деятельности, так и комплексное исследование одного органа, ткани или жидкой среды человеческого организма с определением в них активности разных ферментов. Исследование динамики активности лактатдегидрогеназы, малатдегидрогеназы, сукцинатдегидрогеназы, глюкозо-6-фосфат — дегидрогеназы, кислой и щелочной фосфатаз, катепсинов (см.), холинэстеразной и цитохромоксидазной активности в сочетании с другими методами исследования позволяют довольно точно ответить на вопрос о времени наступления смерти, если срок давности наступления смерти не превышает 48 час. Определение активности и количественная оценка содержания ферментов нашли применение также и при диагностике факта прижизненного происхождения и давности причинения механических повреждений мягких тканей и внутренних органов.
Широкое использование в экспертной практике нашел метод экспресс-диагностики отравления фосфорорганическими соединениями (см.), основанный на определении активности холинэстеразы (см.) в сыворотке крови, так как активность этого фермента резко снижается вплоть до полного исчезновения при отравлении этими соединениями.
Исследования ферментов применяют и при решении некоторых вопросов идентификации личности (см.). В частности, определение изоферментного спектра кислой фосфатазы эритроцитов, фосфатдегидрогеназы, лейцинаминопеитидазы, установление фенотипа холинэстеразы, фосфо-глюкомутазы, аденилаткиназы применяют при исследовании пятен крови для исключения возможного ее происхождения от конкретного подозреваемого, обвиняемого или другого лица.
Исследование изоферментного состава ЛДГ (обнаружение изоферментов ЛДГ, специфичных для семенной жидкости, даже в тех случаях, когда сперматозоиды отсутствуют), определение активности кислой фосфатазы, очень высокой в сперме, применяют для доказательства спермального происхождения пятен.
Определение фенотипа лейцин-аминопептидазы, в частности обнаружение появляющейся начиная с 8—10-й недели беременности и сохраняющейся до 3 недель после родов добавочной фракции этого фермента, применяют для диагностики беременности и бывших родов при исследовании жидкой крови и ее пятен.
Распределение ферментов в органах и тканях
Практически каждая живая клетка содержит свой набор специфических ферментов, поэтому их распределение в различных органах и тканях значительно варьирует. Некоторые ферменты встречаются только в определенном органе. Примерами могут служить орнитин-карбамоилтрансфераза (КФ 2.1.3.3), которая содержится только в печени, и кислая фосфатаза (см. Фосфатазы), самая высокая активность к-рой определяется в предстательной железе. Однако многие ферменты обнаруживаются в различных органах и тканях человека, например лактатдегидрогеназа, аспартат- и аланинаминотрансфе-разы, альдолаза (фруктозобисфосфат-альдолаза; КФ 4.1.2.13) и др., но присутствуют в них в различных концентрациях.
Абсолютно четкие и воспроизводимые измерения активности того или иного фермента во всех тканях провести нелегко, поскольку методы получения тканевого экстракта и перевода фермента в растворимое состояние, пригодные для одной ткани, могут быть недостаточно эффективными для другой; аналогичные трудности существуют и при выборе условий измерения активности фермента.
Локализация ферментов в клетке
Почти все ферменты функционируют внутри тех клеток, в которых происходит их биосинтез. Исключение составляют ферменты пищеварительного тракта, а также некоторые ферменты плазмы крови, в частности участвующие в процессе свертывания крови (см. Свертывающая система крови).
Установлено, что в ядре клетки (см.) локализованы РНК-полимеразы (см. Полимеразы), то есть ферменты, принимающие участие в синтезе рибонуклеиновых кислот всех типов. В ядре содержатся ферменты, катализирующие процессы репликации (см.) и репарации дезоксирибонуклеиновых кислот (см. Репарация генетических повреждений), синтеза НАД и некоторые другие. С митохондриями (см.) связаны ферменты пируватдегидрогеназного комплекса (см. Пировиноградная кислота), цикла трикарбоновых кислот (см. Трикарбоновых кислот, цикл), окисления жирных кислот (см.), синтеза мочевины, ферменты дыхательной цепи (см. Дыхательные ферменты, Цитохромы), окислительного фосфорилирования (см. Окисление биологическое) и др. В лизосомах (см.) в основном содержатся гидролитические ферменты с оптимумом ферментативной активности в области pH 5,0. Именно из-за гидролитического характера локализованных в них фермента эти частицы были названы лизосомами. С рибосомами (см.) связаны ферменты белкового синтеза, катализирующие образование полипептидных цепей из отдельных аминокислот (см. Белки, биосинтез). В эндоплазматической сети (см. Эндоплазматический ретикулум) локализованы ферменты синтеза липидов (см.), а также ферменты, участвующие в реакциях гидроксилирования (ферментная система микросомного окисления). С плазматической мембраной прежде всего связаны АТФ-аза (см. Аденозинтрифосфатазы), обеспечивающая транспорт ионов Na+ и К + , аденилатциклаза (см. Аденозинфосфорные кислоты) и ряд других ферментов. В гиалоплазме (см.) локализованы ферменты гликолиза, пентозного цикла (см. Углеводный обмен), синтеза жирных кислот, мононуклеотидов, активирования аминокислот, многие ферменты глюконеогенеза и др.
Особую группу ферментов составляют полиферментные (мультиферментные), или мультимолекулярные ферментные комплексы (системы), в состав которых входит целый ряд ферментов, катализирующих последовательные реакции превращения какого-нибудь субстрата. Полиферментные системы локализованы в гиалоплазме или во внутриклеточных структурах таким образом, что каждый фермент располагается в непосредственной близости от фермента, катализирующего следующую реакцию в цепи данной последовательности реакций. Благодаря такому расположению уменьшается время, необходимое для диффузии (см.) субстратов и продуктов реакций, то есть вся цепь взаимосвязанных реакций оказывается строго скоординированной во времени и пространстве.
Типичным примером таких систем являются мультиферментные комплексы, катализирующие окислительное декарбоксилирование (см.) пировиноградной и акетоглутаровой кислот, синтез высших жирных кислот, а также перенос электронов от субстратов к кислороду через систему дыхательных ферментов (см.). Приуроченность ферментных систем к определенным внутриклеточным структурам, или компартментализация, обеспечивает протекание в клетке в одно и то же время химически несовместимых реакций. Так, в клетке одновременно происходит окисление высших жирных кислот до ацетил-КоА и противоположно направленный процесс — их синтез из ацетил-КоА. Эти процессы протекают в разных частях клетки: окисление жирных кислот — в митохондриях, а синтез — в гиалоплазме.
Существуют ферменты, которые обнаруживаются в различных участках клетки. Так, аспартатаминотрансфераза (см. Аминотрансферазы) локализована и в митохондриях, и в цитоплазме, однако это два ее изофермента — митохондриальный и цитоплазматический, различающиеся по целому ряду физико-химических свойств. Известны также митохондриальная и цитоплазматическая формы малатдегидрогеназы (см.) и др.
Классификация и номенклатура ферментов
Согласно современной классификации, разработанной Международной комиссией по ферментам Международного биохимического союза и утвержденной на заседании Генеральной ассамблеи Международного биохимического союза в 1961 году в Москве, каждый фермент, включенный в классификацию, имеет шифр, состоящий из четырех чисел, разделенных точками. Первое число определяет класс, второе — указывает подкласс, третье — подподкласс, четвертое — порядковый номер фермента в пределах подподкласса. Все ферменты по типу катализируемой реакции делятся на шесть классов: оксидоредуктазы (см.), трансферазы (см.), гидролазы (см.), лиазы, изомеразы (см.), лигазы (синтетазы). Оксидоредуктазы катализируют окислително-восстановительные реакции (см.); трансферазы — реакции переноса химических групп (см. Переметилирование, Пересульфидирование, Перефосфорилирование, Трансаминирование</span>); гидролазы — реакции гидролиза (см.) субстратов; лиазы — реакции отщепления хим. групп негидролитическим путем; изомеразы — реакции изомеризации различного типа; лигазы (синтетазы) — реакции синтеза, сопряженные с расщеплением АТФ или его аналогов. Классы ферментов, в свою очередь, подразделяются на определенное количество подклассов, которые делятся на подподклассы. Название и номер подкласса характеризуют хим. природу субстрата и той группы атомов в его молекуле, которая изменяется под действием соответствующего фермента, название и номер подподкласса, как правило, уточняют химическую природу этой группы атомов в молекуле субстрата. У лиаз, например, название и номер подподкласса уточняют тип отщепляемой группы, у гидролаз — тип гидролизуемой связи, а у оксидоредуктаз — природу второго субстрата.
Международный биохимический союз принял две номенклатуры ферментов: систематическую и тривиальную (рабочую). Систематическое название состоит из двух частей. Первая часть представляет собой название субстрата (субстратов), вторая часть с окончанием «-аза» указывает на катализируемую ферментом реакцию. В качестве тривиальных названий фермента в большинстве случаев сохранены общепринятые традиционные названия. Например, фермент, расщепляющий гидролитическим путем мочевину на аммиак и диоксид углерода (углекислый газ), относится к классу гидролаз. Его шифр — КФ 3.5.1.5, систематическое название — «мочевина — амидогидролаза», тривиальное название — «уреаза».
Регуляция активности ферментов
Активность ферментов является непостоянной и во многом зависит от различных факторов среды, в которой им приходится действовать. Так основным показателями для активности ферментов являются факторы внутреннего и внешнего воздействия на клетку. Активность ферментов изменяют в каталах, показывающих количество энзима, превращающего за секунду 1 моль субстрата, с которым он взаимодействует. Международная единица измерения – Е, демонстрирующая количество энзима, способного за 1 минуту преобразовать 1 мкмоль субстрата.
Ингибирование ферментов: процесс
Одним из основных направлений в современной медицине и энзимологии в частности является разработка методов управления скоростью метаболических реакций, происходящих с участием энзимов. Ингибированием принято называть уменьшение активности ферментов посредством использования различных соединений. Соответственно, вещество, обеспечивающее специфичное снижение активности белковых молекул, получило название ингибитора. Существует различные виды ингибирования. Так, в зависимости от прочности связывания энзима с ингибитором процесс их взаимодействия может быть обратимым и, соответственно, необратимым. А в зависимости от того, как воздействует ингибитор на активный центр энзима, процесс ингибирования может быть конкурентным и неконкурентным.
Активирование ферментов в организме
В отличие от ингибирования, активация ферментов подразумевает увеличение их действия в происходящих реакциях. Вещества, позволяющие получить необходимый результат, называются активаторами. Такие вещества могут иметь органическую и неорганическую природу. Например, органическими активаторами могут выступать желчные кислоты, глутатион, энтерокиназа, витамин С, разные тканевые ферменты и др. В качестве неорганических активаторов могут использоваться пепсиноген и ионы различных металлов, чаще всего двухвалентных.
Факторы, определяющие активность энзимов
Поскольку энзим способен ускорять реакции во много раз, его активность определяется так называемым числом оборотов. Этот термин обозначает количество молекул субстрата (реагирующего вещества), которую способна трансформировать 1 молекула фермента за 1 минуту. Однако существует ряд факторов, определяющих скорость реакции:
- Концентрация субстрата.
Увеличение концентрации субстрата ведет к ускорению реакции. Чем больше молекул действующего вещества, тем быстрее протекает реакция, поскольку задействовано больше активных центров. Однако ускорения возможно только до тех пор, пока не задействуются все молекулы фермента. После этого, даже повышение концентрации субстрата не приведет к ускорению реакции.
- Температура.
Обычно повышение температуры ведет к ускорению реакций. Это правило работает для большинства ферментативных реакций, но только до тех пор, пока температура не поднимется выше 40 градусов по Цельсию. После этой отметки скорость реакции, наоборот, начинает резко снижаться. Если температура опустится ниже критической отметки, скорость ферментативных реакций повысится снова. Если температура продолжает расти, ковалентные связи рушатся, а каталитическая активность фермента теряется навсегда.
- Кислотность.
На скорость ферментативных реакций также влияет показатель рН. Для каждого фермента существует свой оптимальный уровень кислотности, при котором реакция проходит наиболее адекватно. Изменение уровня рН сказывается на активности фермента, а значит, и скорости реакции. Если изменения слишком велики, субстрат теряет способность связываться с активным ядром, а энзим больше не может катализировать реакцию. С восстановлением необходимого уровня рН, активность фермента также восстанавливается.
Ферменты для пищеварения
Ферменты, присутствующие в человеческом организме, можно разделить на 2 группы:
- метаболические;
- пищеварительные.
Метаболические «работают» над нейтрализацией токсических веществ, а также способствуют выработке энергии и белков. Ну и, конечно, ускоряют биохимические процессы в организме.
За что отвечают пищеварительные – понятно из названия. Но и здесь срабатывает принцип селективности: определенный тип ферментов влияет только на один вид пищи. Поэтому для улучшения пищеварения можно прибегнуть к маленькой хитрости. Если организм плохо переваривает что-то из еды, значит надо дополнить рацион продуктом, содержащим фермент, который способен расщепить трудно перевариваемую пищу.
Пищевые ферменты – катализаторы, которые расщепляют продукты питания до состояния, в котором организм способен поглощать из них полезные вещества. Пищеварительные энзимы бывают нескольких типов. В человеческом организме разные виды ферментов содержатся на разных участках пищеварительного тракта.
Ротовая полость
На этом этапе на пищу воздействует альфа-амилаза. Она расщепляет углеводы, крахмалы и глюкозу, которые содержатся в картофеле, фруктах, овощах и других продуктах питания.
Желудок
Здесь пепсин расщепляет белки до состояния пептидов, а желатиназа – желатин и коллаген, содержащиеся в мясе.
Поджелудочная железа
На этом этапе «работают»:
- трипсин – отвечает за расщепление белков;
- альфа-химотрипсин – помогает усвоению протеинов;
- эластазы – расщепляют некоторые виды белков;
- нуклеазы – помогают расщеплять нуклеиновые кислоты;
- стеапсин – способствует усвоению жирной пищи;
- амилаза – отвечает за усвоение крахмалов;
- липаза – расщепляет жиры (липиды), содержащиеся в молочных продуктах, орехах, маслах и мясе.
Тонкая кишка
Над пищевыми частицами «колдуют»:
- пептидазы – расщепляют пептидные соединения к уровню аминокислот;
- сахараза – помогает усваивать сложные сахара и крахмалы;
- мальтаза – расщепляет дисахариды к состоянию моносахаридов (солодовый сахар);
- лактаза – расщепляет лактозу (глюкозу, содержащуюся в молочных продуктах);
- липаза – способствует усвоению триглицеридов, жирных кислот;
- эрепсин – воздействует на протеины;
- изомальтаза – «работает» с мальтозой и изомальтозой.
Толстый кишечник
Здесь функции ферментов выполняют:
- кишечная палочка – отвечает за переваривание лактозы</span>;
- лактобактерии – влияют на лактозу и некоторые другие углеводы.
Кроме названных энзимов, существуют еще:
- диастаза – переваривает растительный крахмал;
- инвертаза – расщепляет сахарозу (столовый сахар);
- глюкоамилаза – превращает крахмал в глюкозу;
- альфа-галактозидаза – способствует перевариванию бобов, семян, соевых продуктов, корневых овощей и листовых;
- бромелайн – фермент, полученный из ананасов, способствует расщеплению разных видов белков, эффективен при разных уровнях кислотности среды, обладает противовоспалительными свойствами;
- папаин – фермент, выделенный из сырой папайи, способствует расщеплению мелких и крупных протеинов, эффективен в широком диапазоне субстратов и кислотности.
- целлюлаза – расщепляет целлюлозу, растительные волокна (в человеческом организме не обнаружена);
- эндопротеаза – расщепляет пептидные связи;
- экстракт бычьей желчи – энзим животного происхождения, стимулирует моторику кишечника;
- панкреатин – фермент животного происхождения, ускоряет переваривание жиров и белков;
- панкрелипаза – животный фермент, способствует усвоению белков, углеводов и липидов;
- пектиназа – расщепляет полисахариды, содержащиеся во фруктах;
- фитаза – способствует усвоению фитиновой кислоты, кальция, цинка, меди, марганца и других минералов;
- ксиланаза – расщепляет глюкозу из зерновых.
Катализаторы в продуктах
Ферменты имеют решающее значение для здоровья, поскольку помогают организму расщеплять пищевые компоненты до состояния, пригодного для использования питательных веществ. Кишечник и поджелудочная железа производят широкий спектр ферментов. Но кроме этого, многие из полезных веществ, способствующих пищеварению, содержатся также и в некоторых продуктах.
Ферментированные продукты являются практически идеальным источником полезных бактерий, необходимых для правильного пищеварения. И в то время, когда аптечные пробиотики «работают» только в верхнем отделе пищеварительной системы и часто не добираются до кишечника, эффект от ферментативных продуктов ощущается во всем желудочно-кишечном тракте.
- Почему нельзя самостоятельно садиться на диету
- 21 совет, как не купить несвежий продукт
- Как сохранить свежесть овощей и фруктов: простые уловки
- Чем перебить тягу к сладкому: 7 неожиданных продуктов
- Ученые заявили, что молодость можно продлить
Например, абрикосы содержат в себе смесь полезных энзимов, в том числе инвертазу, которая отвечает за расщепление глюкозы и способствует быстрому высвобождению энергии.
Натуральным источником липазы (способствует более быстрому перевариванию липидов) может послужить авокадо. В организме это вещество производит поджелудочная железа. Но дабы облегчить жизнь этому органу, можно побаловать себя, например, салатом с авокадо – вкусно и полезно.
Кроме того, что банан, пожалуй, самый известный источник калия, он также поставляет в организм амилазу и мальтазу. Амилаза содержится также в хлебе, картофеле, крупах. Мальтаза способствует расщеплению мальтозы, так называемого солодового сахара, который в обилии представлен в пиве и кукурузном сиропе.
Другой экзотический фрукт – ананас содержит в себе целый набор энзимов, в том числе и бромелайн. А он, согласно некоторым исследованиям, еще и обладает противораковыми и противовоспалительными свойствами.
Экстремофилы и промышленность
Экстремофилы – это вещества, способны сохранять жизнедеятельность в экстремальных условиях.
Живые организмы, а также ферменты, позволяющие им функционировать, были найдены в гейзерах, где температура близка к точке кипения, и глубоко во льдах, а также в условиях крайней солености (Долина Смерти в США). Кроме того, ученые находили энзимы, для которых уровень рН, как оказалось, также не принципиальное требование для эффективной работы. Исследователи с особым интересом изучают ферменты-экстремофилы, как вещества, которые могут быть широко использованы в промышленности. Хотя и сегодня энзимы уже нашли свое применение в индустрии как биологически и экологически чистые вещества. К применению энзимов прибегают в пищевой промышленности, косметологии, производстве бытовой химии.
Более того, «услуги» ферментов в таких случаях обходятся дешевле, чем синтетических аналогов. Кроме того, натуральные вещества являются биоразлагаемыми, что делает их использование безопасным для экологии. В природе существуют микроорганизмы, способные расщепить ферменты на отдельные аминокислоты, которые затем становятся компонентами новой биологической цепочки. Но это, как говорится, уже совсем другая история.
- Повышение квалификации:
В составе фермента выделяют области, выполняющие различную функцию:
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. В активном центре выделяют два участка:
- якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
- каталитический – непосредственно отвечает за осуществление реакции.
Схема строения ферментов
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора. Например, в реакции превращения пировиноградной кислоты (пируват) в молочную кислоту (лактат) сначала к апоферменту лактатдегидрогеназы присоединяется НАД, формируется активный центр, и только потом входит пируват.
Схема формирования сложного фермента
2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы, называемой активатором или ингибитором (или эффектором, модулятором, регулятором), вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Схема строения аллостерического фермента
В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см «Регуляция активности ферментов»).
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры).
Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа (роль КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, наиболее активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы. Определение активности разных изоферментов КК в сыворотке крови имеет клинико-диагностическое значение.
Изоферменты лактатдегидрогеназы
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. Изоферменты ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2). Определение активности разных изоферментов ЛДГ в сыворотке крови имеет клинико-диагностическое значение.
Еще одним примером изоферментов является группа гексокиназ, которые присоединяют фосфатную группу к моносахаридам гексозам и вовлекают их в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа), которая отличается от остальных изоферментов высокой специфичностью к глюкозе, низким сродством к ней и нечувствительностью к ингибированию продуктом реакции.
Мультиферментные комплексы
В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Возникает туннельный эффект, т.е. субстрат попадает в созданный ферментами «туннель». В результате промежуточные метаболиты избегают контакта с окружающей средой, снижается время их перехода к следующему активному центру и значительно ускоряется скорость реакции.
Строение мульферментного комплекса
Например,
- пируватдегидрогеназный комплекс (пируватдегидрогеназа), превращающий пируват в ацетил-SКоА,
- ?-кетоглутаратдегидрогеназный комплекс (в цикле трикарбоновых кислот) превращающий ?-кетоглутарат в сукцинил-SКоА,
- комплекс под названием «синтаза жирных кислот» (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту
- карбамоилфосфатсинтетаза, первый фермент синтеза мочевины в печени и синтеза пиримидиновых оснований
- https://yandex.ru/health/turbo/articles?id=4522
- https://xn--90aw5c.xn--c1avg/index.php/%D0%A4%D0%95%D0%A0%D0%9C%D0%95%D0%9D%D0%A2%D0%AB
- https://FoodandHealth.ru/komponenty-pitaniya/fermenty/
- https://biokhimija.ru/fermenty/stroenie-fermentov.html

 portal-c.ru
portal-c.ru