Бласты.Что это такое?
Бласты представляют собой незрелые кровяные клетки, которые продуцируются в костном мозге. В дальнейшем они преобразуются в эритроциты, лейкоциты и тромбоциты. Бластные клетки являются предшественниками зрелых кровяных телец.
У здорового человека бласты в костном мозге составляют не более 5 % клеток. При инфекционных заболеваниях их концентрация может возрастать до 10 %. Однако в норме незрелые клетки не должны попадать в кровоток. Они могут находиться только в пределах костного мозга.
При тяжелых гематологических патологиях у пациента появляются бласты в крови. Что это значит? Такой результат анализа указывает на онкологические болезни системы кроветворения. При этих патологиях в костном мозге образуется чрезмерное количество незрелых элементов. Избыток бластов выбрасывается в кровоток. Их наличие в анализе является тревожным признаком.
В начальной стадии рака крови в костном мозге может находиться около 40 % бластных клеток. В дальнейшем из этих незрелых элементов образуется злокачественная опухоль.
Что значат нормобласты в крови
Чтобы определить количество эритроцитов в крови, которые по какой-то причине имеют ядро, используется специальный анализатор. Он выдает результат в анализе в виде количества на сотню лейкоцитов. Бывают случаи, когда бласты принимаются за лейкоциты, что приводит к неверной трактовке анализа. Именно поэтому, когда считаются нормобласты и лейкоциты, вводится поправочный коэффициент, который помогает в получении верного результата.
Определение количества
Если говорить о периферической крови, то такие клетки в ней должны полностью отсутствовать. Дело в том, что образование и перерождение их происходит в костном мозге. Оказываться в крови они могут только в случае повреждения костного мозга, а также при ряде заболеваний, связанных с нарушением кроветворения.
Стоит еще раз подчеркнуть, что в норме нормобласты должны в крови отсутствовать, то есть говорить о каком-то количественном показателе здесь не приходится. Он должен равняться нулю. Однако помните, что исключением из этого правила являются новорожденные дети.
Такие клетки в крови у ребенка в первые дни жизни обнаруживаются запросто, и пугаться здесь не стоит. Дело в том, что причины такого появления кроются в усиленной продукции эритропоэтина в период первых дней жизни. Это приводит к тому, что красные клетки крови и гемоглобин растут в количестве. Новорожденному потребуется порядка нескольких дней для снижения таких показателей.
Нормобласты в крови обнаруживаются у детей в период между вторым и третьим месяцами жизни. Причины все те же – усиленный эритропоэтин. Педиатр вас, скорее всего, успокоит при получении такого анализа, поскольку это физиологическая норма.
После нескольких таких всплесков бласты станут сокращаться в анализе ребенка. За достаточно быстрое время их количество приблизиться к показателю взрослого человека, соответственно, нормобласты станут аномалией для ребенка, обнаружение их станет возможным только в миелограмме.
Именно из-за такого отсутствия в крови многие не придают должного значения данному компоненту своего организма. Дело в том, что такие клетки появляются в анализе только в силу наличия патологии. При этом всегда патологии связаны в той или иной степени с работой костного мозга.
Название нормобласт большинство врачей в настоящее время не используют из-за некоторой неверной интерпретации. Молодой врач может употребить слово нормоцит, однако означать это будет то же самое.
И почему
Подобные метаморфозы кроветворной ткани определены как «полиэтиологичные», поскольку назвать одну причину, безусловно вызывающую патологические изменение в системе кроветворения, бывает весьма затруднительно. Между тем, конкретизируя причины, все же следует указать, на некоторые факторы, особенно обладающие мутагенными свойствами:
- Отдельные химические элементы и соединения – канцерогены, входящие в состав лекарственных препаратов, средств борьбы с вредителями сельского хозяйства, предметов бытовой химии. Достоверно известно, что некоторые антибиотики, НПВП (при длительном применении), цитостатики и химиопрепараты способны вызывать гематологические заболевания. Что касается других чуждых человеческому организму химических веществ, то способности индуцировать лейкоз давно замечены у бензола, мелфалана, хлорбутина, циклофосфана и др.
- Ионизирующее излучение (выпадение радиоактивных осадков после ядерных испытаний, применение радиоактивных изотопов и облучения в промышленности и медицине и др.) признано основным этиологическим фактором патологии кроветворной системы. Наука давно подтвердила существование «радиационных» лейкозов, возникающих много лет спустя среди населения, пережившего ядерную бомбардировку (Япония) или аварию на ближайшей атомной электростанции, а также в числе врачей-рентгенологов, ежедневно подвергающих и свой организм радиационному воздействию, либо больных, которых лечили радиоизотопами или рентгеновскими лучами.
- При большинстве лейкозов можно обнаружить те или иные генетические аномалии (филадельфийская хромосома, транслокация генов), которые долгое время остаются незаметными, поскольку никаких клинических проявлений не имеют. Установление этих причин стало возможным благодаря достижениям цитогенетики.

- Наследственность. Считается, что по наследству передается не сам лейкоз, а информация о геноме онковируса – онкоген (провирус), который неопределенно долго может находиться в организме в репрессированном состоянии, но стимулирующий (канцерогенный) фактор на фоне иммунодефицита при различных заболеваниях активизирует «спящую» форму, и она начинает вызывать клеточную трансформацию в кроветворных органах. Иначе, как объяснить появление лейкоза в одной семье через несколько поколений? К числу наследственных, ассоциированных с лейкозами заболеваний, причисляют и такие хромосомные поломки (или нерасхождение какой-то пары), которые, казалось бы, к опухолям не имеют никакого отношения. Однако, характерная для болезни Дауна трисомия 21 пары или генная транслокация, повышает риск развития лейкоза в 20 раз. При спонтанных разрывах хромосом (болезнь Фанкони, Клайнфельтера, Тернера) также отмечается повышение частоты встречаемости гемобластозов. Кроме этого, наследственные болезни, связанные с иммунодефицитом нередко становятся причиной развития лейкоза.
- Вирусы в качестве мутагена напрямую не причисляют к специфическим факторам, вызывающим заболевание. Вместе с тем и особых оснований умалять их значимость вроде бы нет. Они могут быть провокаторами онкогенеза, а, кроме всего прочего, негативно влияют на иммунитет, что иной раз является предпосылкой развития клеточной трансформации.
Таким образом, возникновение и развитие гемобластозов может иметь не одну причину, а цепь событий, запускающих мутацию или активирующих онкоген уже имеющийся в организме, в результате которых образуется клетка опухоли, которая начинает безграничное клонирование себе подобных. Повторная мутация, произошедшая в опухолевой клетке, ведет к прогрессии и становлению неопластического процесса. Сочетание нескольких провоцирующих факторов, безусловно, приведет к учащению случаев заболеваний.
Нормы бластных клеток в анализе крови, диагностика и расшифровка результатов
Анализ крови – главное и первое исследование, которое назначают врачи при поступлении пациента в больницу. Он полно, быстро и дешево выдает объем информации о состоянии больного. Однако такие анализы различны, один из вариантов — исследование на количество бластных телец. Что это, зачем они нужны и какой нормальный уровень в крови? Разберемся!
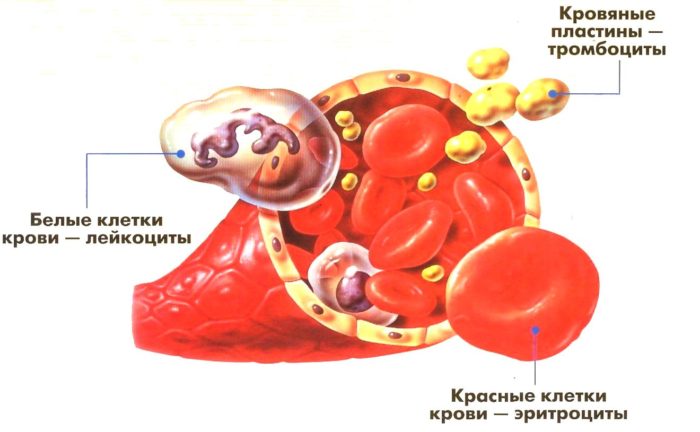
Кровь – важнейшая жидкость в организме человека. Выполняет множество функций,: от питания до защиты органов от инфекций и бактерий. За каждую «задачу» отвечают клетки крови, например: эритроциты – красные кровяные тельца, доставляют кислород в уголки человеческого тела.
Предшественниками элементов крови являются бласты. Развиваются в спинном мозге и по мере необходимости превращаются в эритроциты, лейкоциты и так далее. Здоровые тельца готовы «преобразиться» во время острых кризисов в больших количествах, появляясь в крови в виде защитных или других клеток.
Острый лейкоз — следствие нарушения в работе кроветворения на сначальных стадиях. В нормальном состоянии бластные клетки превращаются в функциональные клетки крови и выполняют свою миссию. Каждое такое тельце сразу после «появления на свет» имеет свою линию развития. Например: для эритроцитов «производятся» один вид таких клеток, а для лейкоцитов — другой и так далее.
Когда кроветворная система дает сбой, и создание здоровых базовых клеток нарушается, тельца ведут себя по-другому. Они не превращаются в «рабочие» клетки – только потребляют полезные вещества и размножаются. Со временем заменяют здоровые клетки и проникают в кости, разрушая их, не поставляя полезных веществ. Резко снижается количество полезных клеток, падает гемоглобин, тромбоциты и лейкоциты.
Обозначаться могут, например: острый В-лимфобластный лейкоз, что подразумевает сбой в создании бластов на уровне «производства» таких элементов, как В-лимфоциты или острый монобластный лейкоз, который возник при проблемах в создании моноцитов. В зависимости от степени сложности и вида лейкоза прогнозы на излечение пациента разные.
Бластные клетки в анализе крови не имеют нормы. В хорошем состоянии организма, когда отсутствуют стрессы и заболевания, стандартным количеством таких элементов в костном мозге будет 1 %. Они постепенно заменяют «отработавшие свое» элементы, и кроветворный орган восполняет эту недостачу, не превышая нормы.
В случае стресса, вирусной или бактериальной инфекции, костный мозг увеличит количество бластных телец до 10%. В исключительных случаях количество может быть немного больше. Любые другие показатели означают отклонения в работе системы.
Если число бластных телец доходит до 20% — это означает, что развивается такое заболевание, как острый лейкоз. Они бывают разных видов и форм, протекают быстро и относятся к раковым заболеваниям. Такое отклонение может проявиться совершенно неожиданно, даже у тех, кто в жизни не болел ничем серьезным. Это случается с детьми и людьми молодого возраста. У старшего поколения лейкозы вторичного характера, вызванные заболеваниями или лечениями, например: химиотерапией.
Что значат бластные клетки в анализе крови, норма которых превышена? На самом деле такие тельца в «незрелом» виде не должны выходить за пределы костного мозга. Туда отправляются полностью сформировавшиеся по предназначению элементы, которые готовы выполнять свою функцию. Если бласты в крови, это свидетельствует о запущенном раке.
Из вышесказанного можно сделать выводы:
- Бластные тельца должны отсутствовать в крови, их нормальное место обитание – костный мозг.
- В обычном состоянии такие элементы не должны превышать 1% от количества крови.
- До 10% бластных телец находится в костном мозге во время острой необходимости (болезни, инфекции).
- Более 20 % в костном мозге и нахождение деформиованных бласт в крови означают наличие острого лейкоза.
Точный диагноз, определяющий наличие лейкоза, можно поставить и до попадания бласт в кровь. Для этого достаточно общего клинического анализа крови, на котором виден уровень эритроцитов и другие сопутствующие показатели.
Заболеть острым лейкозом может человек, кошка, собака или другое живое существо, имеющее соответствующее строение тела. В любом случае это серьезное раковое заболевание, которое требует немедленного лечения. Шансы на успешный исход зависят от стадии заболевания, состояния и здоровья больного, вида лейкоза.
Анализ крови при лейкозе
Все лейкозы можно разделить на два вида – острые и хронические. При остром лейкозе происходит поражение молодых клеток крови 2 или 3 поколения, реже 4 поколения. А вот хронический лейкоз выражается в поражении зрелых клеток или созревающих лейкоцитов.
Существует несколько названий лейкозов. Происходят они от тех названий клеток крови, которые поражаются в этом случае. Например, лимфобластный лейкоз – это поражение лимфобластов. Миелобластный лейкоз – поражение миелобластов. В норме бластных клеток в крови не должно быть вообще. Но если они есть, то это значит, что костный мозг просто не справляется из-за болезни со своими функциями.
Бластные клетки очень сильно отличаются от нормальных клеток крови. При этом они в несколько раз превышают их в размере, но иногда бывают и меньше нормы. К тому же анализ крови при лейкозе может показать такое состояние клеток крови, как анизоцитоз, то есть одинаковые по названию клетки крови имеют совершенно разные размеры. Контуры ядер лейкоцитов при лейкозе очень часто сильно деформированы, а в самом костном мозге находится большое количество ещё очень незрелых лейкоцитов.
Именно по количеству бластных клеток в крови и определяется стадия и выраженность лейкоза. При остром лейкозе бласты в крови занимают лидирующие позиции – их может находиться в кровяном русле до 60 процентов от общего числа всех клеток. При этом могут полностью отсутствовать промежуточные формы клеток. Такое состояние организма называется лейкемический провал.
Анализ крови при лейкозе также показывает очень сильную анемию и снижение или полное отсутствие таких клеток крови, как тромбоциты.
При хроническом лейкозе бластные клетки в крови могут и не обнаружиться. А если они там есть, то их содержится как правило не долее 10%. Здесь нет лейкемического провала. То есть присутствуют как промиелоциты, так и миелоциты. К тому же в крови обнаруживается базофилия и эозинофилия, что выявляется одновременно. Ну, а сама анемия прогрессирует при хроническом лейкозе довольно таки медленно.
Сам же диагноз острый или хронический лейкоз ставится только после анализа крови. При этом не придётся сдавать какой-то особый или дорогостоящий анализ. Достаточно сдать кровь из пальца, а через несколько часов получить результат. Делается такой анализ в любой лаборатории.
Определения бластных клеток в анализе крови, симптомы заболевания
Как правило, лейкоз делится на два вида. Это распространенный лейкоз и острый лейкоз. Подобное разделение зависит не только от клинического прохождения, но и в связи с параметрами опухоли в клеточном составе. Также отличаются характеристики анализа крови. Врачами острый лейкоз характеризируется как некое образование, где молодые клетки это основа клеточного слоя. Таким заболеванием страдают больше всего дети. Эта болезнь характеризуется ускоренным метастазированием клеток. У пациентов можно заметить внекостномозговые проявления. В результате этого плохо функционирует сердце, почки, и органы пищеварения.
Когда уже случай довольно развитый, в кровяной системе выделяются определенные клетки развивающего типа и определенное количество довольно зрелых компонентов. Врачи наименуют данную принадлежность «провалом лейкемии», когда клетки не могут перейти из одной формы в другую. А в анализе заболевшего нет эозинофилов и базофилов.
Если различные параметры моментально начинают изменяться в анализе крови, значит, образовались тромбоциты. Если заболевший имеет мегакариобластной лейкоз, следовательно, тромбоциты в значимой форме превышают текущую норму. В случае критического лейкемического лейкоза для того, чтобы правильно определить состав крови применяют способ лейкоконцентрации. Он, как правило, базируется на седиментации определенных форменных компонентов.
Исследование костного мозга
Если у пациента в крови обнаружены бласты, то врачи обычно назначают пункцию костного мозга. Исследование проводят под местным обезболиванием. Специальной длинной иглой делают прокол в области грудины или позвоночника и берут на исследование кусочек ткани костного мозга.
Пунктат исследуют при помощи микроскопа. В биоматериале определяют количество зрелых и незрелых элементов крови. Повышение бластных клеток до 10 % не всегда указывает на лейкемию. Такой результат исследования возможен при сильном стрессе или инфекционном заболевании. Если же концентрация бластов превышает 30 %, то это чаще всего является признаком рака крови. При этом у больного уменьшается количество эритроцитов, тромбоцитов и лейкоцитов в пункционном материале.
При подозрении на лейкоз также проводят цитохимический анализ пунктата. Он позволяет выявить уровень ферментов бластных клеток. Эти вещества вступают в реакцию с некоторыми красителями, что и используется при лабораторном исследовании. Положительные результаты пробы указывают на лейкоз. С помощью измерения уровня каждого бластного фермента можно определить форму рака крови.
Кровь после химиотерапии
Применение большинства цитостатиков неблагоприятно отражается на кроветворении пациента, какие-то препараты убивают больше клеток крови, какие-то, как винкаалкалоиды, почти не изменяют анализа. Для каждого противоопухолевого препарата определён процент вероятности тяжелого падения лейкоцитов, но применение комбинаций лекарств, причём неоднократно на протяжении нескольких недель, отметает все прогнозы на благополучный исход — пройти химиотерапию без потерь для кроветворения.
Не все ростки крови повреждаются цитостатиками одинаково, больше всех страдают лейкоциты, не подготовленные природой к долгой жизни — срок их существования чуть меньше двух недель, а потому и нестойкие к превратностям противоопухолевого лечения.
Тромбоциты живут чуть меньше, но приемлемый уровень поддерживается большим числом — их в 30-40 раз больше лейкоцитов. Тромбоцитопения — снижение числа тромбоцитов ниже 150 тысяч развивается при использовании небольшого числа цитостатиков, к примеру, тиофосфамида, часто начинается вместе с лейкопенией, но нормализация численности тромбоцитов задерживается на несколько недель после завершения цикла химиотерапии. Критический уровень тромбоцитов 32-34 тысячи, когда существенно возрастает риск кровотечения.
Красное кровяное тельце — эритроцит должен жить почти 120 дней, только через 3-4 месяца ему на смену из костного мозга выйдет молодая клетка, поэтому он более устойчив к химиотерапии и по организму их циркулирует 2-4 миллиона. Анемия — снижение гемоглобина и числа эритроцитов характерно для очень небольшого числа цитостатиков, как правило, к ней приводят несколько циклов химиотерапии платиновыми производными.
Последствия анемии фатальны — не только ухудшается качество, но снижается продолжительность жизни и меняется чувствительность к лекарственному лечению, и при глубокой анемии противопоказано проведение химиотерапии даже для спасения жизни. Особенность постхимиотерапевтической анемии в нормальном содержании железа, то есть она не железодефицитная, я связана с недостаточным воспроизводством популяции красных кровяных клеток.
Устойчивость оболочки эритроцита к внешнему воздействию, в том числе к химиотерапии, определяет скорость их выпадения в осадок, проверяемую реакцией оседания эритроцитов в пробирке за 60 минут — СОЭ. СОЭ возрастает при дефектах красных кровяных телец, химиотерапия способна деформировать эритроцит, но в большей мере от цитостатиков страдает именно воспроизводство клеток крови в костном мозге.
В большинстве случаев СОЭ после ХТ изменяется относительно исходного показателя не очень сильно и часто параллельно содержанию в эритроците гемоглобина. Вопреки расхожему мнению, СОЭ мало реагирует на течение онкологического заболевания, но активно изменяется при воспалении или инфекции, нередко сопровождающих распространенную злокачественную опухоль. Высокая СОЭ часто сочетается с анемией.
Активнее всех на химиотерапию реагируют лейкоциты, составляемые пятью фракциями: нейтрофилы, эозинофилы, лимфоциты, моноциты и базофилы. Самые чувствительные к цитостатикам — нейтрофилы, в анализе крови их обозначают, как палочкоядерные и сегментоядерные лейкоциты. В норме нейтрофилов должно быть не менее 1500, то есть не меньше половины всех лейкоцитов, именно они отвечают за противостояние иммунитета воспалению и инфекции.

Снижение фракции лимфоцитов, представленных главными иммунными защитниками Т-лимфоцитами и клетками иммунной памяти В-лимфоцитами, после химиотерапии часто не явное и не столь разительное, как нейтрофилов. Выраженная лимфопения характерна для тяжелых нарушений иммунитета, ВИЧ/СПИД в том числе. После химиотерапии пациенты отмечают некоторое учащение заболеваемости вирусными респираторными инфекциями, но исследований по проблеме не проводилось, неизвестно насколько личное впечатление соответствует действительности. Предполагают, что при успешной химиотерапии злокачественной опухоли показатели иммунитета только улучшаются.
Трансаминазы крови — АЛТ и АСТ отражают не влияние противоопухолевых препаратов на клеточные фракции крови, а повреждающее действие цитостатиков и иммуноонкологических препаратов на печеночную ткань. Химиопрепараты приводят к токсическому гепатиту, а иммунные противоопухолевые лекарства — к аутоиммунному гепатиту. Гепатиты могут протекать бессимптомно и проявляться только изменением уровня трансаминаз, причём в зависимости от тяжести печеночного повреждения АЛТ может повышаться втрое и даже более чем в 20 раз превышать верхнюю границу нормы.
Бласты в анализе крови после химиотерапии
Клетки костного мозга, способные к быстрому частому делению. Различают злокачественные (анаплазированные) бласты — лейкозные клетки, и нормальные (всегда содержатся в костном мозге, но их менее 5%). При лейкозах количество анаплазированных бластов в костном мозге сильно возрастает; они могут заселять также различные органы и ткани — печень, селезенку, почки, лимфатические узлы, головной мозг, могут появляться в крови.
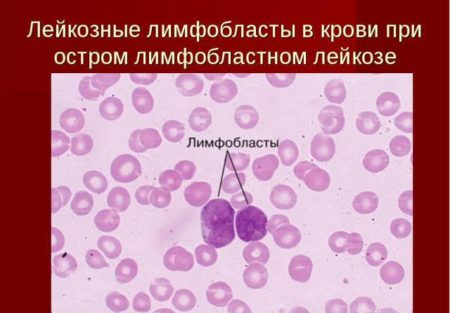
Бласты очень похожи на лейкоциты, и поэтому иногда в момент постановки диагноза «лейкоз» Вам могут сказать, что число лейкоцитов очень высокое. На самом деле это бласты. Бластные клетки — недифференцированные клетки, наиболее молодые элементы крови, отличающиеся от других клеток крови и костного мозга строением ядра. Характерным признаком бластной клетки является наличие крупных ядрышек (от 2 до 5 на одну клетку).
Бласты могут быть отнесены к гранулоцитарному, лимфоидному или эритроидному ряду. В норме бластов в периферический крови не должно быть, так как это незрелые формы кровянных клеток, и зреют они полностью непосредственно в костном мозге. В некоторых случаях появление 1-2% бластов в крови возможно, когда костный мозг восстанавливает свою работу после аплазии. Это, как правило, не злокачественные бласты.
Острый миелобластный лейкоз
Острый миелобластный лейкоз (ОМЛ) – это злокачественный процесс в костном мозге, нарушающий функцию кроветворения. Заболевание поражает миелоидный росток. Здоровая клетка лейкоцит не созревает и выходит в кровоток в изменённом виде. Начинается неконтролируемое деление. Лейкоциты лишены способности защищать организм от микроорганизмов и инфекций. Угнетается производство эритроцитов и тромбоцитов. Начинает развиваться анемия и тромбоцитопения. Изменяется состав периферической крови.
Причины, провоцирующие развитие болезни, до конца не изучены. Учёные связывают ряд факторов с мутациями кроветворной системы, к примеру, наследственность, облучения или генетические аномалии.
Миелоидная лейкемия наиболее часто диагностируется у взрослых пациентов. Болезнь поражает людей после 50 лет. Пик развития рака приходится на 63 года. Миелоидному лейкозу больше подвержены пожилые мужчины. Среди молодого поколения одинаково страдают представители обоих полов.
У детей заболевание носит первичный характер. Ребёнок подвергается лейкозу при аномалиях в генетическом коде, при контакте матери с тяжёлыми отравляющими веществами (радиация, канцерогены) или если история болезней кровных родственников содержит онкологические патологии. Симптомы болезни как у взрослых.
В начале заболевания клиническая картина смазана. Постепенно больной замечает необычные изменения в состоянии. При остром течении болезни пациент отмечает симптомы самочувствия:

- Утомляемость;
- Одышка;
- Синяки и мелкие кровоподтеки;
- Кровоточивость слизистой ротовой полости;
- Инфекционные поражения организма, не поддающиеся классическому лечению и имеющие ярко выраженную симптоматику.
Для лейкозов терминальной стадии развития костный мозг лишается работоспособности, метастазы поражают органы и системы человеческого тела. Для этого характерны признаки:
- Значительное снижение веса;
- Бледность кожных покровов;
- Желудочно-кишечные и носовые кровотечения;
- Слабость;
- Боль и ломота в костях;
- Обмороки;
- Рвота с кровью;
- Чёрный стул;
- Боли в животе;
- Если поражается мочеполовая система, отмечается частичная или полная задержка мочи.
Лечением занимаются онкогематологи. Код по МКБ-10 миелолейкоза С92.
Общая характеристика
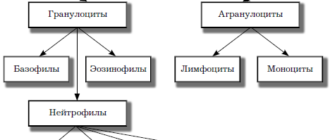
Предшественники клеток крови делятся на 2 большие группы – лимфоцитарный и миелоцитарный росток. Лимфоцитарный росток создает лимфоциты: клетки, «ответственные» за реакции иммунитета. Миелоцитарный росток развивается (дифференцируется) в эритроциты, тромбоциты, нейтрофильные лейкоциты и гранулоциты. Незрелые клетки крови называются бластными.
Таким образом, острый миелобластный лейкоз – это опухоль, возникшая из незрелых клеток миелоцитарного ростка кроветворения.
Диагноз считается установленным, если в анализе костного мозга (миелограмме) оказывается более 20% бластных клеток.
Классификация онкологической патологии
Нелимфобластный лейкоз представляет группа подвидов болезни. Для каждого вида шансы выживаемости и тактика лечения подбираются индивидуально.
Система ФАБ состоит из 9 разновидностей острого миелоидного лейкоза. Формы отличаются по типам предшественников лейкоцитов и степеням их зрелости. Клетки определяют при проведении микроскопического и цитогенетического исследования.
Клетки крови при тысячекратном увеличении
- Показатель М0 означает минимально-дифференцированную острую миелоидную лейкемию.
- М1 характеризует миелоцитарный лейкоз без созревания. В единичных бластах обнаруживаются азурофильные гранулы и палочки Ауэра.
- При М2 для лейкоза характерно созревание. Бласты преимущественно с палочками Ауэра и азурофильными гранулами.
- М3 обозначает острую форму промиелоцитарного рака крови. Клетки гипергранулированы. Палочки Ауэра присутствуют множественно.
- М4 представляет острый миеломонобластный онкологический процесс.
- При М4ео наблюдается миеломоноцитарная патология с повышенным уровнем эозинофилов в костном мозге.
- М5 определяет острый монобластный (-цитарный) лейкоз.
- М6 характеризует острые эритроидные заболевания крови.
- М7 означает мегакариобластную лейкемию.
- Подвид М8 представляет базофильное малокровие.
Лечебная тактика
Лечение проводится в стационарных условиях, где снижается контакт с окружающим миром. Клинические рекомендации заключаются в проведении химиотерапии. Онкогематолог выбирает соответствующий протокол для каждого случая. При диагнозе «Острый миелобластный лейкоз» врачи подбирают комбинацию препаратов. Интенсивная химиотерапия помогает вылечиться и войти в стойкую ремиссию.
Проведение процедуры химиотерапии
На первом этапе лечения назначенные препараты без разбора убивают здоровые и раковые клетки. Развиваются побочные явления:
- Тошнота;
- Рвота;
- Вялость;
- Язвенные поражения полости рта;
- Назальные кровотечения;
- Организм больного подвержен присоединению опасных инфекций.
На втором этапе назначают несколько курсов цитостатиков. Для уничтожения рака важен приём высокой дозы цитозин-арабинозида. Препарат препятствует созданию частиц, переносящих наследственную информацию. При печёночной и почечной недостаточностях или угнетении костного мозга приём препарата запрещен.
Для угнетения функций костного мозга и борьбы с опухолевыми клетками назначают Идарубицин.
Митоксантрон подавляет иммунитет и уничтожает опухоли.
Для достижения максимальной эффективности используют протоколы с тремя блоками постремиссионной химии.
Прогноз жизни на фоне химиопрепаратов значительно улучшается.
При поражении органов центральной нервной системы рекомендована лучевая терапия. Ионизирующее излучение вступает в реакцию с аномальными клетками, нарушает их структуру и провоцирует гибель.
Среди людей ходят истории об исцелении рака крови с помощью народной медицины. Однако ни один метод или препарат не показал 100% эффективности. Отказываясь от врачебного вмешательства, больной позволяет лейкозу стремительно развиваться и нарушать работу жизненно важных органов! Лечением может заниматься только квалифицированный врач онколог после проведения тщательной диагностики. Нетрадиционные методы обычно только усугубляют течение болезни.
Полное выздоровление наступает после пересадки костного мозга. Метод имеет нюансы и последствия:
- До начала проведения операции (вливание донорского материала через установленный в артерию катетер) больному уничтожают костный мозг с помощью ударных доз химиотерапии.
- При отсутствии иммунитета любые инфекции и болезни, к примеру, ОРЗ или царапина могут привести к летальному исходу.
- Трансплантируемый материал может не взаимодействовать с организмом пациента:
- В первом случае чужой костный мозг организм человека воспринимает за чужеродный и отторгает его. Нарушается работа всех органов. Иммунные клетки убивают все на своем пути. Однако при этом окончательно уничтожаются раковые клетки без возможности развиться снова. Иммуносупрессивная терапия помогает наладить нормальный кроветворный процесс.
- Организм пациента отвергает введенные стволовые клетки. Иммунитет не формируется. Выработка кровяных телец не начинается.
- При введении биоматериала развивается аллергия или анафилактический шок.
- Половина пациентов умирают в первый месяц после операции.
Пересадка костного мозга
Подходящий костный мозг трудно достать. Лучшими донорами являются однояйцевые близнецы, родные братья и сестры. Материал родителей подходит очень редко.
Стволовые клетки могут быть взяты у самого пациента в период ремиссии или у постороннего человека.
Адекватность химиотерапии
В зарубежных клинических рекомендациях этого фактора нет, к сожалению, он актуален исключительно для России. Даже правильно назначенные медикаменты могут оказаться менее эффективны, чем нужно, при уменьшении расчетных доз лекарства, несоблюдении интервалов между курсами и подобные «внешние» факторы. Кроме этого, принадлежность к той или иной группе риска у взрослых определяет необходимость трансплантации костного мозга, и если цитогенетического исследования не было, отнести пациента к одной из трех групп невозможно. Российские клинические рекомендации предлагают ориентироваться на клинические признаки как факторы неблагоприятного прогноза:
- возраст старше 40 лет;
- лейкоцитов крови > 100 х 109/л;
- наличие экстрамедуллярных поражений;
- после первого курса химиотерапии не наступила ремиссия;
- вторичный ОМЛ (возник после курса химиотерапии другого злокачественного новообразования);
Лечение и прогноз: взрослые
Факторы, влияющие на прогноз у взрослых пациентов, можно разделить на 3 группы:
- Индивидуальные особенности организма и состояния здоровья;
- Биологические характеристики лейкемического клона;
- Правильный подбор метода лечения.
Прогнозы на жизнь
Шанс на полное выздоровление имеют 90% пациентов до 60 лет. Пожилой организм не справляется с раком и нагрузками при химиотерапии. Пациент до конца жизни использует паллиативное лечение. Пятилетняя выживаемость пожилых людей составляет 12-25%.
Шанс на выживаемость снижается при наличии сопутствующих онкологических проблем или заболеваний генетического типа (болезнь Дауна). Рецидив развивается в любой момент. Вторичное заболевание не поддаётся лечению.
Если больной в течение 5 лет не отмечал симптомы лейкоза и не обращался за помощью, его снимают с онкологического учёта и считают здоровым.
Специфическая профилактика лейкемии отсутствует.
- https://FB.ru/article/421713/blastyi—eto-opredelenie-ponyatie-norma-i-patologiya-rasshifrovka-analizov
- https://obsleduem.net/all/blastnye-kletki-v-analize/
- https://www.euroonco.ru/departments/himioterapiya/analiz-krovi-posle-himioterapii
- https://domofoniya.com/krov/blasty-v-analize-krovi-posle-himioterapii/
- https://onko.guru/zlo/ostryj-mieloblastnyj-lejkoz.html
- https://RosOnco.ru/gemoblastozy/ostryj-mieloblastnyj-lejkoz

 portal-c.ru
portal-c.ru